![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
77 Cards in this Set
- Front
- Back
- 3rd side (hint)
|
1. 강열감량시험법
|
이 방법은 강열하였을 때 그 구성성분의 일부 또는 혼재물이 소실되는 무기약품에 적용한다.
조 작 법 - 검체를 넣을 백금, 석영 또는 사기로 만든 도가니 또는 접시를 미리 의약품각조에서 규정하는 온도로 항량이 될 때까지 강열하고 방치하여 식힌 다음 그 질량을 정밀하게 단다. 검체는 의약품각조에서 규정하는 양의 ± 10 % 범위 내에서 달아 앞의 용기에 넣어 그 질량을 정밀하게 단다. 이것을 의약품각조에서 규정하는 조건으로 강열하고 데시케이터 (실리카겔) 속에서 방치하여 식힌 다음 그 질량을 정밀하게 단다. |
강열감량시험법은 검체를 의약품각조에서 규정하는 조건으로 강열하여 그 감량을 측정하는 방법이다.
의약품각조에, 예를 들면 40.0 ~ 52.0 % (1 g, 450 ~ 550 ℃, 3 시간)라고 규정하는 것은 검체 약 1 g을 정밀하게 달아 450 ~ 550 ℃에서 3 시간 강열할 때 그 감량이 이 약 1 g에 대하여 0.400 ~ 0.520 g임을 나타내는 것이다. |
|
|
2. 강열잔분시험법
|
이 방법은 보통 유기물 중에 불순물로 들어 있는 무기물의 함량을 알기 위하여 쓰나, 때에 따라서는 유기물 중에 구성성분으로 들어있는 무기물 또는 강열할 때 휘발하는 무기물 중에 들어있는 불순물의 양을 측정하는 데 쓴다.
조 작 법 - 검체를 넣을 백금, 석영 또는 사기로 만든 도가니를 미리 600 ± 50 ℃로 30 분간 강열하여 데시케이터 (실리카겔 또는 다른 적당한 건조제)에서 방치하여 식힌 다음 그 질량을 정밀하게 단다. 의약품각조에서 규정하는 양의 검체를 달아 이 도가니에 넣고 그 질량을 정밀히 단다. 다음 검체에 황산 소량(보통 1 mL)을 넣어 적시고 될 수 있는 대로 낮은 온도에서 천천히 가열하여 검체를 완전히 탄화시킨다. 일단 방치하여 식힌 다음 다시 황산 소량(보통 1 mL)으로 적시고 흰 연기가 나지 않을 때까지 천천히 가열하고 다시 600 ± 50 ℃로 강열하여 잔류물을 완전히 회화한다. 조작 중에는 불꽃을 내면서 연소하지 않도록 주의한다. 도가니를 데시케이터 (실리카겔 또는 다른 적당한 건조제)에서 방치하여 식힌 다음 그 질량을 정밀하게 달아 잔분의 백분율을 계산한다. |
강열잔분시험법은 검체를 다음 조작법에 따라 강열할 때 휘발하지 않고 남는 물질의 양을 측정하는 방법이다.
의약품각조에, 예를 들면 0.1 % 이하 (1 g)라고 규정하는 것은 이 약 약 1 g을 정밀하게 달아 다음 조작법에 따라 강열하였을 때 그 잔분이 이 약 1 g에 대하여 1 mg 이하임을 나타낸다. 또 「건조한 다음」이라고 규정하는 때에는 건조감량 항의 조건으로 건조한 다음 검체를 채취한다. |
|
|
3. 건조감량시험법
|
이 방법은 건조하였을 때 소실되는 검체 중의 수분, 결정수의 전부 또는 일부 및 휘발성물질 등의 양을 측정하기 위하여 쓴다.
조 작 법 - 칭량병을 미리 의약품각조에서 규정하는 방법에 따라 30 분간 건조하여 질량을 정밀하게 단다. 검체는 의약품각조에서 규정하는 양의 ± 10 % 범위 내에서 달아 칭량병에 넣고 따로 규정이 없는 한 그 층의 높이가 5 mm 이하가 되도록 편 다음 그 질량을 정밀하게 단다. 이것을 건조기에 넣고 의약품각조에서 규정하는 조건으로 건조한다. 검체가 큰 덩어리일 때에는 재빨리 갈아 지름 2 mm 이하로 하여 쓴다. 건조한 다음 건조기에서 칭량병을 꺼내어 그 질량을 정밀하게 단다. 가열하여 건조할 경우에는 의약품각조에서 규정하는 온도의 ± 2 ℃에서 가열하여 건조하고 건조한 다음에는 데시케이터 (실리카겔) 속에서 방치하여 식힌다. 의약품각조에서 규정하는 건조온도보다 낮은 온도에서 융해하는 검체는 융해온도보다 5 ~ 10 ℃ 낮은 온도에서 1 ~ 2 시간 건조한 다음 의약품각조에서 규정하는 조건으로 건조한다. 건조제는 의약품각조에서 규정하는 것을 쓰며 때때로 바꾸어 준다. |
건조감량시험법은 검체를 의약품각조에서 규정하는 조건으로 건조하여 그 감량을 측정하는 방법이다.
의약품각조에, 예를 들면 1.0 % 이하 (1 g, 105 ℃, 4 시간)라고 규정하는 것은 이 약 약 1 g을 정밀하게 달아 105 ℃에서 4 시간 건조할 때 그 감량이 이 약 1 g에 대하여 10 mg 이하임을 나타내며 또 0.5 % 이하 (1 g, 감압, 산화인(V), 4 시간)라고 규정하는 것은 이 약 약 1 g을 정밀하게 달아 산화인(V)을 건조제로 한 데시케이터 속에서 4 시간 감압건조할 때 감량이 이 약 1 g에 대하여 5 mg 이하임을 나타낸 것이다. |
|
|
4. 결정성시험법
|
편광현미경을 써서 검체의 결정성을 보는 시험법이다.
조 작 법 - 검체를 광유에 띄워 적당한 편광현미경으로 시험한다. 검체 소량에 유동파라핀 1 ~ 2 방울을 떨어뜨리고 약간 흔들어 섞고 편광현미경으로 90°씩 회전시켜 검경한다. 검체가 미세한 가루일 때는 유침법으로 검경한다. 검체가 결정일 때 복굴절과 소광현상을 나타낸다. |
|
|
|
5. 광유시험법
|
주사제 및 점안제에 쓰이는 비수성용제 중의 광유를 시험하는 방법이다.
조 작 법 - 검체 10 mL를 100 mL 플라스크에 넣고 수산화나트륨용액(1 → 6) 15 mL 및 에탄올 30 mL를 넣는다. |
플라스크 입구에 다리가 짧은 작은 깔때기를 다리가 아래로 향하도록 놓고 때때로 흔들어 섞으면서 수욕에서 맑아질 때까지 가열한다. 다음에 얕은 사기접시에 옮겨 수욕에서 가열하여 에탄올을 증발시키고 잔류물에 물 100 mL를 넣어 수욕에서 가열할 때 액이 혼탁하지 않는다.
|
|
|
6. 굴절률측정법
|
검체의 공기에 대한 굴절률을 측정하는 방법이다.
제 2 매질의 제 1 매질에 대한 굴절률 또는 상대굴절률이라 하며 n으로 나타낸다. n = sin i / sin r 제 1 매질이 진공인 경우의 굴절률을 제 2 매질의 절대굴절률이라 하며 N으로 나타낸다. 보통 온도는 20 ℃, 광선은 나트륨스펙트럼의 D선을 쓰며, n20D 으로 나타낸다. 조 작 법 - 굴절률은 보통 아베굴절계로 의약품각조에서 규정하는 온도의 ± 0.2 ℃ 범위 내에서 측정한다. 아베굴절계는 흰색광을 써서 nD를 직접 읽을 수 있으며 측정할 수 있는 nD의 범위는 1.3 ~ 1.7이고 정밀도는 0.0002이다. |
등방성 물질인 경우 파장, 온도 및 압력이 일정할 때 굴절률은 그 물질의 고유한 정수로서 물질의 순도시험 또는 균질한 두 물질의 혼합물의 조성결정 등에 쓰인다.
|
|
|
7. 금속성이물시험법
|
안연고제의 금속성이물을 시험하는 방법이다.
판 정 - 금속성이물의 합계는 50 개 이하이고 개개의 페트리접시는 8 개를 초과하는 것이 1 매 이하일 때 적합하다. 만일 적합하지 않을 때에는 다시 20 개를 가지고 같은 방법으로 조작하여 시험하고 30 개에 대하여 50 μm 이상의 금속성이물의 수의 합계가 150 개 이하이고 또 개개의 페트리접시는 8 개를 초과하는 것이 3 매 이하일 때 적합하다. |
검체의 조제 - 이 제제 10 개를 취하여 될 수 있는 대로 청결한 곳에서 각각 5 g 씩을 달아 지름 60 mm인 밑이 평평한 페트리접시에 넣은 다음 뚜껑을 덮고 85 ~ 110 ℃에서 2 시간 가열하여 기제를 완전히 녹인다. 이것을 흔들리지 않게 조심하면서 실온에서 방치하여 굳힌다. 내용량이 5 g 미만일 때는 될 수 있는대로 전체량을 완전하게 꺼내 동일하게 조작한다.
조 작 법 - 페트리접시를 뒤집어 마이크로미터가 붙은 40 배 이상 배율의 현미경으로 관측한다. 광원은 위쪽에서 45°의 각도로 비추고 각각의 페트리접시바닥에서 50 μm 이상의 금속성이물의 개수를 센다. 시험에 사용하는 페트리접시는 기포, 흠 등이 없고 안쪽 면의 둘레와 밑면의 각도가 될 수 있는 대로 직각인 것을 쓴다. . |
|
|
8. 기체크로마토그래프법
|
적당한 고정상을 써서 만든 칼럼에 검체혼합물을 주입하고 이동상으로 불활성기체 (운반기체)를 써서 고정상에 대한 유지력의 차를 이용하여 각각의 성분으로 분리하여 분석하는 방법이다. 기체검체 또는 기화할 수 있는 검체에 적용할 수 있으며 물질의 확인, 순도시험, 정량 등에 쓴다. 칼럼에 주입된 혼합물은 각 성분이 고유한 비율 k로 이동상 및 고정상에 분포한다.
k = 고정상에존재하는양 / 이동상에존재하는양 장치 - 보통 운반기체도입부, 유량제어장치, 검체도입부, 칼럼, 칼럼항온조, 검출기 및 기록장치로 되어 있고 필요하면 연소기체, 조연(助燃)기체 및 부가(付加)기체 등의 도입장치, 유량제어장치, 헤드스페이스용검체도입장치 등을 쓴다. 검출기는 칼럼에서 분리된 성분을 검출하는 것으로 알칼리열이온화검출기, 염광광도검출기, 질량분석계, 불꽃이온화검출기, 전자포획검출기, 열전도도검출기 등이 있다. 기록장치는 검출기에 의하여 얻어진 신호의 강도를 기록하는 것이다. |
이 비율 k, 이동상의 칼럼통과시간 t0 (k = 0인 물질을 주입한 때부터 그 물질의 피크정점까지의 시간) 및 유지시간 tR (피검검체의 주입한 때부터 피검물질의 피크정점까지의 시간)과의 사이에는 다음과 같은 관계가 있으므로 같은 조건인 경우 유지시간은 물질의 고유한 값이 된다.
tR = (1 + k)t0 |
|
|
8. 기체크로마토그래프법 - 확인 및 순도 시험
|
이 방법을 확인시험에 사용하는 경우 검액의 피검성분과 표준피검물질의 유지시간이 일치하는 것 또는 검액에 표준피검물질을 첨가하여도 피검물질의 피크 모양이 유지되는 것으로 확인시험을 한다. 이 방법을 순도시험에 사용하는 경우 보통 검액 중 혼재물의 한도에 대응하는 농도의 표준액을 쓰는 방법 또는 면적백분율법으로 시험한다. 따로 규정이 없는 한 검액의 이성체비는 면적백분율법으로 구한다. 면적백분율법은 크로마토그램에서 얻은 각 성분의 피크면적의 합계를 100으로 하고 이에 대한 각 성분의 피크면적비로부터 조성비를 구한다. 다만 정확한 조성비를 얻기 위해서는 혼재물의 주성분에 대한 감도계수에 의해 피크면적을 보정한다.
|
|
|
|
8. 기체크로마토그래프법 - 정 량
|
1) 내부표준법
2) 절대검량선법 3) 표준첨가법 |
1) 내부표준법 - 내부표준법에서는 일반적으로 피검물질에 되도록 가까운 유지시간을 가지며 그 어느 피크와도 완전하게 분리되는 안정한 물질을 내부표준물질로 선택한다.
2) 절대검량선법 - 표준피검물질을 단계적 농도가 되도록 취하여 여러 개의 표준액을 만들고 표준액 일정량씩을 정확하고 재현성 있게 주입하여 크로마토그램을 얻는다. 3) 표준첨가법 - 4 개 이상의 일정한 양의 검액을 정확하게 취한다. 이 중 1 개를 제외한 나머지 검액에 피검물질의 표준액을 단계적 농도가 되도록 정확하게 넣는다. |
|
|
피크측정법 - 1) 피크높이측정법
|
가) 피크높이법
나) 자동피크높이법 |
가) 피크높이법 - 피크의 정점에서 기록지의 가로축으로 내린 수직선과 피크의 양끝을 연결하는 접선 (기저선)과의 교점으로부터 정점까지의 길이를 측정한다.
나) 자동피크높이법 - 검출기로부터의 신호를 데이터처리장치를 써서 피크높이를 측정한다 |
|
|
피크측정법 - 2) 피크면적측정법
|
가) 반치폭법 - 피크높이의 1/2 위치에서의 피크폭에 피크높이를 곱한다.
나) 자동적분법 - 검출기로부터의 신호를 데이터처리장치를 써서 피크면적을 측정한다. |
|
|
|
8. 기체크로마토그래프법 - 시스템적합성
|
1) 검출의 확인
2) 시스템의 성능 3) 시스템의 재현성 |
1) 검출의 확인 - 순도시험에서 대상으로 하는 유연물질 등의 피크가 그 규격한도값 수준의 농도에서 확실하게 검출되는 것을 확인함으로서 사용하는 시스템이 시험의 목적을 달성하기 위해 필요한 성능을 갖추고 있다는 것을 검증한다.
2) 시스템의 성능 - 피검성분에 대한 특이성이 확보되어 있음을 확인하는 것으로서 사용하는 시스템이 시험의 목적을 달성하기 위해 필요한 성능을 가진다는 것을 검증한다. 3) 시스템의 재현성 - 표준액 또는 시스템적합성용액을 반복하여 주입했을 때 대상성분의 측정값들의 정밀도가 시험의 목적에 적절한 수준인지를 확인하여 해당 시스템이 시험에 적합한 성능을 갖추고 있는지를 검증한다. |
|
|
8. 기체크로마토그래프 - 조작조건의 변경에 관한 유의사항
|
의약품각조의 조작조건 중에서 칼럼의 안지름 및 길이, 충전제의 입자경, 고정상의 농도 또는 두께, 칼럼온도, 가온속도, 운반기체의 종류 및 유량, 분할비는 시스템적합성의 규정에 적합한 범위 내에서 일부 변경할 수 있다. 다만, 헤드스페이스용검체주입장치 및 그 조작조건은 규정하는 방법보다 더 좋은 정확도와 정밀도를 얻을 수 있는 범위 내에서 변경할 수 있다.
|
|
|
|
S/N 비 (Signal to Noise ratio)
|
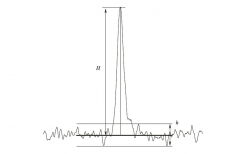
S/N = 2H / h
H : 대상물질의 피크의 기저선 (노이즈의 중앙값)으로부터 피크높이 h : 검액 또는 공시험액 중 대상물질의 피크 주변의 크로마토그램의 노이즈의 폭 기저선 및 노이즈는 대상물질의 피크높이의 1/2 위치 피크폭의 20 배에 해당하는 범위에서 측정한다. 공시험액을 사용하는 경우에는 대상물질이 유출하는 위치 근처에서 위와 같은 범위에서 측정한다. |
|
|
|
대칭계수
|

|
|
|
|
상대표준편차
|

RSD (%) = 100 × 표준편차 / 측정값의 평균값
|
|
|
|
피크밸리비
|
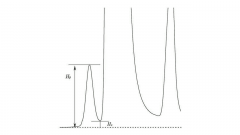
크로마토그램 상의 두 피크 사이에서 기저선 분리가 얻어지지 못하는 경우에 해당 피크들 사이의 분리의 정도를 표시한다. 피크밸리비 p/v는 다음의 식으로 정의한다.
p/v = Hp / Hv Hp : 크로마토그램의 작은 피크의 기저선으로부터의 피크높이 Hv : 크로마토그램의 큰 피크와 작은 피크 사이의 가장 낮은 지점 (피크의 밸리)의 기저선으로부터의 높이 |
|
|
|
분리계수
|

|
|
|
|
분리도
|

|
|
|
|
이론단수
|

|
|
|
|
9. 무균시험법
|
이 시험법은 무균이 요구되는 원료 또는 제제에 적용한다. 이 시험에 적합하다는 결과는 단지 이 시험조건에서 시험한 검체 중에 오염미생물이 검출되지 않았음을 의미한다
|
|
|
|
9. 무균시험법 - 미생물오염에 대한 예방조치
|
무균시험은 무균조건에서 시험한다. 따라서 시험환경은 무균시험을 실시하는데 적합하여야 한다. 오염을 피하기 위한 예방조치는 이 시험으로 검출되는 어떠한 미생물에도 영향을 주어서는 안된다. 시험하는 작업영역은 적절한 샘플링과 적절한 관리로 정기적으로 모니터링 한다.
|
|
|
|
9. 무균시험법 - 배지와 배양온도
|
1) 일반요건 - 배지는 다음과 같이 조제하거나 배지성능시험에 적합한 경우에는 동등한 시판배지도 쓸 수 있다.
2) 액상티오글리콜산배지 - 변형티오글리콜산배지는 한천과 레사주린용액을 제외하고 액상티오글리콜산배지와 같은 조성으로 만들어, 밸리데이션된 조건에서 멸균한다. 멸균한 다음의 pH가 7.1 ± 0.2가 되도록 조정하고, 사용직전에 수욕에서 가열한다. 변형티오글리콜산배지는 혐기조건에서 30 ~ 35 ℃로 배양한다. 3) 대두카제인소화배지 - 용액을 실온으로 식히고 필요하면 수산화나트륨시액을 넣어 멸균한 다음의 pH가 7.3 ± 0.2가 되도록 조정한다. 필요하면 여과하여 적당한 용기에 필요한 양씩 나누어 넣고 밸리데이션된 조건으로 멸균한다. 바로 쓰지 않을 경우에는 미리 멸균된 기밀용기에 넣어 2 ~ 25 ℃에서 보존한다. 밸리데이션된 기간이 지난 배지를 사용해서는 안 된다. 대두카제인소화배지는 20 ~ 25 ℃에서 배양한다. |
|
|
|
9. 무균시험법 - 배지의 적합성
|
1) 배지의 무균성 - 배지의 일부를 14 일간 배양할 때 미생물의 증식이 나타나지 않는다.
2) 호기성균, 혐기성균 및 진균에 대한 배지성능시험 - 세균은 3일을 넘지 않도록 진균은 5일을 넘지 않도록 배양한다. |
액상티오글리콜산배지에는 다음 미생물을 소량 (100 CFU 이하) 접종한다. 각 미생물에 대하여 별도의 배지용기를 쓴다. : Clostridium sporogenes, Pseudomonas aeruginosa, Staphylococcus aureus 대두카제인소화배지에는 다음 미생물을 소량 (100 CFU 이하) 접종한다. 각 미생물에 대하여 별도의 배지용기를 쓴다. : Aspergillus brasiliensis, Bacillus subtilis, Candiida albicans 세균은 3일을 넘지 않도록 진균은 5일을 넘지 않도록 배양한다. 접종균의 계대수는 시드로트 배양관리방법 (seed lot system)을 채택하여 마스터시드로트 (master seed lot)로부터 5 대를 넘지 않도록 한다. 미생물의 증식이 육안으로 명백하게 관찰될 때 그 배지는 적합하다.
|
|
|
9. 무균시험법 - 측정법의 적합성시험
|
1) 멤브레인필터법 - 시험할 용기의 내용물을 여과한 다음, 최종회의 세정액에 시험용 균주 100 CFU 이하를 넣고 여과한다.
2) 직접법 - 시험할 용기의 내용물을 배지에 넣은 다음 시험용 균주 100 CFU 이하를 그 배지에 접종한다. 측정법의 적합성시험은「검체의 무균시험」과 동시에시험할 수도 있다. |
어느 접종방법에서든 배지의 적합성 2) 호기성균, 혐기성균 및 진균에 대한 배지성능시험 항에 제시된 균주를 쓴다. 양성대조로서 배지성능시험을 한다. 배지를 함유한 모든 용기는 규정온도에서 최장 5 일간 배양한다. 배양 후 양성대조와 동등하고 육안으로 명확한 증식이 있으면 검체는 이 시험조건에서 항균활성이 없거나 항균활성이 충분히 제거된 것으로 본다. 이 측정법은 무균시험으로 적합하며 시험조건을 변경할 필요가 없다. 만일 검체 존재 하에 양성대조와 동등하고 육안으로 명확한 증식이 없으면, 검체는 이 시험조건에서 항균활성이 충분히 제거되지 않은 것이다. 이 때는 항균활성을 제거하기 위해 조건을 변경하고 측정법의 적합성시험을 반복한다.
|
|
|
9. 무균시험법 - 측정법의 적합성시험을 수행하는 경우
|
1) 새로운 검체에 대하여 무균시험을 하는 경우
2) 시험조건의 변경이 있는 경우 |
예를 들면 여과 가능한 수성, 알코올성 또는 유성의 제품 및 이 시험 조건에서 항균력이 없는 수성 또는 유성의 용제에 혼화 또는 용해하는 제품에 대해서 적용한다.
|
|
|
9. 무균시험법 - 검체의 무균시험
|
1) 일반요건 - 시험에는 적당한 음성대조를 쓴다. 멤브레인필터법은 여과 가능한 제품에 적용한다.
2) 멤브레인필터법 - 멤브레인필터는 미생물의 포집효율이 확립되어 있는 공경 0.45 μm 이하의 것을 쓴다. |
예를 들면 셀룰로오스질산염 필터는 수용성, 유성, 저농도의 알코올성 용액에, 셀룰로오스아세테이트 필터는 고농도의 알코올성 용액에 쓴다. 항생물질과 같은 의약품에는 따로 적절한 필터가 필요한 경우도 있다.
다음에 제시한 방법은 지름 50 mm의 멤브레인필터를 사용한다고 가정한 방법이다. 만약 지름이 다른 필터를 쓰면 희석 및 세정액의 용량은 이에 따라 조정한다. 여과기나 멤브레인필터는 적절한 방법으로 멸균한다. 여과장치는 무균조건에서 검액을 도입하여 여과할 수 있으며, 멤브레인필터를 무균적으로 취하여 배지에 이식할 수 있고, 여과기 자체에 배지를 넣어서 배양하기에 적합하도록 설계되어야 한다. |
|
|
검체의 무균시험 - 2) 멤브레인필터법
|
가) 수성액제 - 1 g/L의 육제 또는 카제인제 펩톤용액 (pH 7.1 ± 0.2)과 같은 무균 희석액의 소량을 여과기 중의 멤브레인필터 위로 옮기고 여과한다. 예를 들면 항생물질이 시험대상일 때에는 희석액에 적당한 중화제나 불활화제를 넣을 수 있다.
나) 수용성 고형제 - 첨부한 용제, 주사용수, 생리식염주사액 또는 1 g/L 육제 또는 카제인제 펩톤중성용액과 같은 적당한 용제에 녹이고, 선택한 용제에 적합한 멤브레인필터를 써서 가) 수성액제 항에 따라 시험한다. 라) 연고제 및 크림 - 지방기제의 연고제나 유중수형의 유제는 위에 서술한 바와 같이 미리스틴산이소프로필로 1 %로 희석한다. 필요하면 40 ℃ 이하로 가온한다. 예외적으로 44 ℃ 이하까지의 가온이 필요한 것도 있다. 가능한 신속히 여과한 다음 다) 기름 및 유성액제 항에 따라 조작한다. |
필요하면 시험할 용기의 내용물을 측정법의 적합성시험에서 선택한 무균 희석액으로 희석한 다음, 표 2에 제시된 검체의 양 이상을 1 장 또는 복수의 멤브레인필터 위에 넣어 즉시 여과한다. 검체가 항균활성을 가지고 있을 때에는 측정법의 적합성시험에서 사용한 무균 희석액의 양으로 멤브레인필터를 3 회 이상 세정한다. 측정법의 적합성시험에서 항균활성을 충분히 제거되지 않은 것이 증명되어도, 멤브레인필터당 100 mL의 세정액으로 5 회 이상 세정하지 않는다. 멤브레인필터를 여과기로부터 꺼내어 반으로 절단하거나 미리 검액을 이등분하여, 각각에 대하여 동일한 여과조작을 하여 얻은 2 장의 멤브레인필터를 각각 배지에 넣는다. 각 배지의 양은 측정법의 적합성시험으로 확립된 양을 쓴다. 또는 멤브레인필터를 장착한 여과기 내에 검액을 이등분해 여과한 다음 각각에 배지를 넣는다. 배지를 14 일 이상 배양한다.
|
|
|
검체의 무균시험 - 각 배지 당 최소 검체 채취량
|
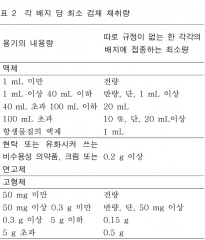
|
|
|
|
검체의 무균시험 - 3) 직접법
|
따로 규정이 없는 한 표 2에 규정된 양의 검체를 그 용량이 배지용량의 10 %를 넘지 않도록 배지에 직접 접종한다. 검체가 항균활성이 있을 때에는 적당한 중화제로 중화시키거나 충분한 양의 배지로 희석하여 시험한다. 대용량의 검체를 사용할 필요가 있을 때에는 접종에 의한 희석영향을 고려하여 고농도의 배지를 쓰는 것이 바람직한 경우도 있다. 적절하다면 고농도 배지를 용기내의 검체에 직접 넣는 것도 가능하다.
|
가) 유성액제 측정법의 적합성시험에서 적합하다는 것이 증명된 적당한 유화제를 적절한 농도 (예를 들면 10 g/L 폴리소르베이트 80)로 넣은 배지를 쓴다.나) 연고제와 크림 1 g/L 육제 또는 카제인제 펩톤중성용액과 같은 적당한 무균희석용액에 선택한 유화제를 넣고 유화하여 약 1 : 10으로 희석한 다음 유화제를 함유하지 않은 배지에 이식한다. 접종된 배지는 14일 이상 배양한다. 배양기간 중에 배양 상태를 수 회 관찰한다. 유성검체를 함유한 배양물을 매일 조용히 흔든다. 그러나 혐기성균 검출을 위해 액상티오글리콜산배지를 쓸 때에는 혐기조건을 유지하기 위해 흔들어 섞는 것을 최소한으로 한다.
|
|
|
검체의 무균시험 - 시험에 필요한 최소 검체수
|

|
|
|
|
9. 무균시험법 - 관찰과 결과의 판정
|
배양기간 중 및 최종일에 배지에서의 미생물의 증식유무를 육안으로 조사한다. 검체가 배지를 혼탁시켜 미생물증식의 유무를 육안으로 쉽게 판정할 수 없을 때에는 배양 시작일로부터 14 일 후에 해당 배지의 일부 (1 mL 이상)를 같은 배지의 새로운 용기에 이식하고, 본래의 배지와 이식시킨 배지를 4 일 이상 배양한다.
|
|
|
|
9. 무균시험법 - 조건 중 1 개 이상 해당될 경우 이 시험은 무효로 한다
|
a) 무균시험시설의 미생물학적 모니터링 데이터에 문제가 나타난 경우
b) 무균시험 중에 쓴 시험방법을 조사한 결과 문제가 나타난 경우 c) 음성대조 중에 미생물의 증식이 나타난 경우 d) 해당 무균시험으로부터 분리된 미생물을 동정한 다음 그 균종의 증식이 무균시험 실시 중에 쓴 재료 및 용기 모두, 또는 어느 한 쪽에 문제가 있음이 명확히 판단되는 경우 |
시험이 무효인 것이 판명되면 최초 시험과 같은 수의 용기를 써서 재시험을 행한다. 재시험에서 미생물의 증식이 관찰되지 않을 때 검체는 무균시험에 적합하다. 재시험에서 미생물의 증식이 관찰될 경우에 검체는 무균시험에 적합하지 않다.
|
|
|
9. 무균시험법 - 무균시험 적합이 요구되는 주사제, 안연고제, 점안제 및 다른 비주사제에 대한 시험 적용
|
멤브레인필터법을 쓸 때에는 가능하면 용기내의 전량을 쓴다. 단, 표 2에 표시한 양 이상을 쓴다. 필요하면 1 g/L 육제 또는 카제인제 펩톤 중성용액과 같은 적당한 무균용액으로 약 100 mL로 희석한다.
직접법을 쓸 때에는 따로 규정이 없는 한 표 2에 제시한 양을 쓴다. 시험제품의 동일한 검체에 대하여 세균 및 진균에 대한 무균시험을 한다. 1 용기 중의 내용량이 두 시험을 하는데 불충분한 경우는 2 용기 이상의 내용물을 다른 배지에 접종하는데 쓴다. |
|
|
|
10. 미생물한도시험법
|
미생물한도시험법은 생균수시험 및 특정미생물시험을 포함한다. 원료 또는 제제에서 임의로 선택한 다른 수 개소 (또는 부분)에서 채취한 것을 잘 섞어 검체로 하여 시험한다.
|
검체를 액체배지로 희석할 때는 신속하게 시험한다. 또한 이 시험을 할 때에는 생물학적 위해가 일어나지 않도록 충분히 조심한다
|
|
|
생균수시험 - 1) 서문
|
이 시험은 호기조건에서 증식할 수 있는 중온성 (中溫性)의 세균 및 진균을 정량적으로 측정하는 방법이다.
|
이 시험은 원료 또는 제제가 규정된 미생물학적 품질규격에 적합한지 여부를 판정하는 것을 주 목적으로 한다. 채취검체수를 포함하여 지시된 시험방법에 따라 시험하여 결과를 판정한다. 생균을 유효성분으로 함유하는 제품에는 이 시험을 적용하지 않는다. 약전시험법과 동등성이 인정되는 경우에 자동화법을 포함한 다른 미생물학적방법을 적용할 수 있다
|
|
|
생균수시험 - 2) 기본조작
|
검체가 항균활성을 가지고 있을 때는 항균활성을 가능한 한 제거 또는 중화한다. 이를 위해 불활성화제를 쓸 때는 그 불활성화제가 유효성이 있으며, 미생물에 대한 독성이 없음을 확인한다.
|
생균수 측정은 검체가 외부로부터의 미생물 오염을 방지할 수 있도록 설계된 조건에서 시험한다. 오염을 방지하기 위한 예방조치는 시험에서 검출하고자하는 어떤 미생물에 대해서도 영향을 주어서는 안 된다.
검체의 조제에 계면활성제를 쓸 때는 미생물에 대한 독성이 없으며 또한 사용하는 불활성화제와 상호작용이 없음을 확인한다 |
|
|
생균수시험 - 3) 생균수측정법
|
보통 멤브레인필터법 또는 한천평판법을 쓴다. 최확수 (Most Probable Number ; MPN)법은 대체로 정밀도가 낮은 균수 측정법이기는 하나 오염균수가 아주 적은 검체에 대해서는 최적의 방법이 될 수도 있다.
|
측정법의 선택은 검체의 특성과 규정된 미생물한도값 등에 근거하며, 선택한 측정법은 규격에 적합한지 여부를 판단하기에 충분한 양의 검체를 시험할 수 있어야 하고 적합성이 확인되어야 한다
|
|
|
생균수시험 - 4) 배지성능, 측정법의 적합성 및 음성대조
|
가) 일반요건 - 검체 존재 하의 미생물 검출능력을 확인한다. 그리고 시험결과에 영향을 주는 시험법의 변경이나 검체의 처방변경이 있는 경우에는 다시 적합성을 확인한다.
나) 시험균의 조제 - 시험균 현탁액의 조제는 pH 7.0 펩톤염화나트륨완충액 또는 pH 7.2 인산완충액을 쓴다. Asperigillus brasiliensis의 포자를 현탁할 때는 완충액에 폴리소르베이트 80을 0.05 % 넣어도 된다. 현탁액은 2 시간 이내에 쓰며 2 ~ 8 ℃로 보존하는 경우에는 24 시간 이내에 쓴다. 다) 음성대조 - 시험조건을 확인하기 위해 검액 대신 사용한 희석액을 써서 음성대조시험을 한다. 미생물이 증식해서는 안 된다. 음성대조는 5)항에 따른 검체시험 시에도 측정한다. 시험에 실패한 음성대조는 고찰한다. 라) 배지성능 - 미생물의 소량 (100 CFU 이하)을 대두카제인소화액체배지의 일부, 대두카제인소화한천배지 및 사부로포도당한천배지의 평판에 접종한다. 한천배지에서는 접종균의 출현집락수가 표준화된 균액의 측정값의 1/2 ~ 2 배 이내 이어야 한다. 바) 결과 및 판정 - 멤브레인필터법 또는 한천평판법의 적합성을 확인할 때 모든 시험균의 평균측정값이 ②항에서 정의한 대조액 (검체 불포함)의 측정값의 1/2 ~ 2 배 이내이어야 한다. 최확수법의 적합성을 확인할 때에는 측정값은 대조에서 얻은 결과의 95 % 신뢰한계 범위 이내이어야 한다. 기술한 어떠한 방법에서도 시험균 하나 또는 그 이상의 균종에서 위의 기준을 충족시키지 못하는 경우에는 기준에 가장 근접한 방법과 시험조건으로 검체를 시험한다. |
|
|
|
생균수시험 - 검체 존재 하의 측정법의 적합성 - ① 검액의 조제
|
ⅰ) 수용성제제 - 검체를 pH 7.0 펩톤염화나트륨완충액, pH 7.2 인산완충액 또는 대두카제인소화액체배지로 녹이거나 희석한다 (보통 10 배 희석액을 조제한다). 필요하면 pH 6 ~ 8로 조정한다. 희석이 더 필요할 때에는 같은 희석액으로 조제한다.
ⅱ) 물에 녹지 않는 비지질제제 - 검체를 pH 7.0 펩톤염화나트륨완충액, pH 7.2 인산완충액 또는 대두카제인소화액체배지에 현탁한다 (보통 10 배 희석액을 조제한다). 분산하기 쉽게 하기 위해 예를 들면 폴리소르베이트 80 (농도 : 1 g/L)과 같은 계면활성제를 넣을 수 있다. 필요하면 pH 6 ~ 8로 조정한다. 희석이 더 필요할 때에는 같은 희석액으로 조제한다. ⅲ) 지질제제 - 검체를 여과멸균한 미리스틴산이소프로필에 녹이거나 필요하면 40 ℃ 이하 (예외적인 경우에는 45 ℃ 이하)에서 가온한 최소필요량의 멸균된 폴리소르베이트 80 또는 다른 저해성이 없는 계면활성제를 써서 혼합한다. 필요하면 수욕에서 그 온도를 유지하면서 주의깊게 섞는다. 선정한 희석액을 미리 가온하여 넣어 검체의 10 배 희석액을 조제한다. 유화에 필요한 가장 짧은 시간 동안 온도를 유지하면서 주의하여 섞는다. 적절한 농도의 멸균한 폴리소르베이트 80 또는 다른 저해성이 없는 계면활성제를 함유하는 같은 희석액으로 10 배 단계 희석계열을 조제해도 된다. |
ⅳ) 에어로솔형의 액체 또는 고체 검체를 무균적으로 멤브레인필터장치에 넣거나 검체 채취를 위해 멸균용기로 옮긴다. 각 검체용기에서 전량을 쓰거나 정량분무한 일정량을 쓴다.
ⅴ) 경피흡수패취 경피흡수패취의 보호피복 (박리라이너)을 제거하고 점착면을 위로 향하게 하여 멸균유리 또는 멸균플라스틱트레이 (tray) 위에 놓는다. 패취끼리 부착하는 것을 막기 위해 멸균한 다공성물질 (예를 들면 멸균거즈)로 점착면을 덮는다. 폴리소르베이트 80 및/또는 레시틴 등의 불활성화제를 함유하는 선정한 희석액 적당량에 패취를 넣고 적어도 30 분간 세게 흔들어 섞는다 |
|
|
생균수시험 - 검체 존재 하의 측정법의 적합성 - ② 접종 및 희석
|
100 CFU 이하의 접종균을 얻는데 충분한 양의 시험균 현탁액을 ①항에 따라 조제한 검액 및 대조액 (검체 불포함)에 넣는다. 접종하는 시험균 현탁액의 양은 검액량의 1 %를 초과하지 않도록 한다.
|
제품에서 허용가능한 미생물 회수결과를 얻기 위해 가장 낮은 희석배율의 검액을 가지고 시험한다. 항균활성 또는 낮은 용해도 때문에 가장 낮은 희석배율의 검액으로 시험할 수 없는 경우에는 다시 적절한 시험방법을 확립한다. 검체로 인한 증식저지를 피할 수 없는 경우에는 중화, 희석 또는 여과한 다음에 시험균 현탁액을 넣어도 된다.
|
|
|
생균수시험 - 검체 존재 하의 측정법의 적합성 - ③ 항균활성의 중화·제거
|
② 및 ④항에 기재한 방법에 따라 시험하여 검액에서 회수한 균수와 대조액에서 회수한 균수를 비교한다. 증식이 저해되는 경우 (검액에서 회수한 균수가 대조액에서 회수한 균수의 1/2 미만인 경우)에는 결과의 유효성을 확보하기 위해 생균수 측정법을 변경한다. 방법의 변경은 예를 들어 (1) 희석액 또는 배지의 증량, (2) 특이적 또는 일반적인 중화제를 희석액에 첨가, (3) 막여과 또는 (4) 위의 측정법의 조합 등이다.
중화제 - 항균제의 활성을 중화하기 위해 중화제를 쓸 수 있다 (표 I-2). 중화제는 선정한 희석액 또는 배지에 멸균 전에 미리 첨가할 수 있다. 중화제를 쓴 경우에는 그 유효성과 미생물에 대한 독성이 없음을 증명하기 위해 검체를 함유하지 않고 중화제만을 넣어 공시험하여 확인한다 |
적절한 중화법을 확립할 수 없는 경우에는 그 검체가 가지는 항균활성 때문에 접종균을 분리할 수 없는 것으로 간주한다. 따라서 그 검체가 접종균과 같은 종의 균이나 근연종에 오염되었을 가능성은 낮은 것으로 생각한다. 그러나 그 검체가 이들 일부 미생물만을 저해할 뿐이고, 시험균주 이외의 균주는 저해하지 않을 가능성도 있으므로 미생물의 증식과 그 허용기준에 적합한 가장 낮은 농도로 시험한다
|
|
|
생균수시험 - 검체 존재 하의 측정법의 적합성 - ④ 검체에서의 미생물 회수 - i) 멤브레인필터법
|
공경 0.45 μm 이하의 멤브레인필터를 쓴다. 필터의 재질은 검체의 성분에 의하여 세균포집능력이 영향을 받지 않도록 주의하여 선택한다. 표 I-1의 각 미생물마다 1 개의 멤브레인필터를 쓴다. ① ~ ③항에 따라 조제한 검체의 적당량 (가능하면 검체의 1 g 해당량 또는 다수의 집략형성이 예측되는 경우에는 그 이하)을 멤브레인필터에 넣어 바로 여과하고 적당량의 희석액으로 멤프레인필터를 씻는다. 멤브레인필터를 총호기성미생물수 (total aerobic microbial count ; TAMC) 측정용으로는 대두카제인소화한천배지의 표면으로, 총진균수 (total combined yeasts/mould count : TYMC) 측정용으로는 사부로포도당한천배지의 표면으로 옮긴다. 표 I-1 에 기재한 조건으로 이들 평판을 배양한 다음 집락수를 측정한다.
|
|
|
|
생균수시험 - 검체 존재 하의 측정법의 적합성 - ④ 검체에서의 미생물 회수 - ii) 한천평판법
|
가. 한천평판혼합법 - 지름 9 cm의 페트리접시를 쓸 때는 페트리접시에 ① ~ ③항에 따라 조제한 검체 1 mL 및 미리 45 ℃ 이하로 보온한 15 ~ 20 mL의 대두카제인소화한천배지 또는 사브로포도당한천배지를 넣는다. 보다 큰 페트리접시를 쓸 때에는 크기에 맞게 한천배지량을 증가한다. 표 I-1에 제시한 미생물마다 적어도 2 개의 페트리접시를 쓴다. 표 I-1에 기재한 조건으로 평판배지를 배양한다. 배지마다 균주의 산술평균을 가지고 집락수를 계산한다.
나. 한천평판도말법 - 지름 9 cm의 페트리접시를 쓸 때는 15 ~ 20 mL의 대두카제인소화한천배지 또는 사부로포도당한천배지를 약 45 ℃일 때 넣어 굳힌 다음 층류식 캐비넷이나 항온기 중에서 평판배지를 건조한다. 보다 큰 페트리접시를 쓸 때에는 크기에 맞게 한천배지량을 증가한다. 표 I-1에 기재한 미생물마다 적어도 2 개의 페트리접시를 쓴다. ① ~ ③항에 따라 조제한 검체 0.1 mL 이상을 정확하게 취하여 배지표면전체에 편다. ii) 가.에 기재한 것과 같이 배양하여 측정한다 |
|
|
|
생균수시험 - 검체 존재 하의 측정법의 적합성 - ④ 검체에서의 미생물 회수 - iii) 최확수법
|
최확수법의 정밀도 및 정확도는 멤브레인필터법 또는 한천평판법 보다 낮다. 특히 곰팡이를 측정할 때는 신뢰성이 낮다. 이러한 이유로 최확수법은 다른 방법의 이용이 불가능할 때의 총호기성미생물수의 측정에 이용한다
|
이 법을 적용할 때에는 다음과 같이 한다. ① ~ ③항에 따라 검체의 적어도 각각 3 개씩의 10 배 단계 희석계열을 조제한다. 각 희석단계로부터 각각 1 g 또는 1 mL 씩을 취하고 대두카제인소화액체배지가 9 ~ 10 mL 들어있는 3 개의 시험관에 각각 접종한다. 필요하면 폴리소르베이트 80과 같은 계면활성제 또는 항균제의 불활성화제를 배지에 첨가할 수 있다. 따라서 3 단계의 희석계열을 조제한 경우에는 9 개의 시험관에 접종하는 것이 된다. 모든 시험관을 30 ~ 35 ℃에서 3 일을 넘지 않는 기간 동안 배양한다. 검체의 성질로 인해 결과의 판정이 곤란하거나 불확실한 경우에는 같은 배지 또는 대두카제인소화한천배지에 이식한 다음 같은 온도에서 1 ~ 2 일간 배양하고 이 결과를 쓴다. 표 I-3 으로부터 검체 1 g 또는 1 mL 당 미생물의 최확수를 구한다
|
|
|
생균수시험 - 5) 검체의 시험
|
가) 시험량 - 따로 규정이 없는 한 위에 기술한 대로 주의하여 채취한 검체 10 g 또는 10 mL를 쓴다.
나) 검체 시험 ① 멤브레인필터법 ② 한천평판법 -ⅰ) 한천평판혼합법 ⅱ) 한천평판도말법 ③ 최확수법 다) 결과의 판정 - 대두카제인소화한천배지를 써서 측정된 집락수를 총호기성미생물수 (TAMC)로 한다. 이 배지 위에 진균의 집락이 검출되어도 TAMC로 계산한다. 사부로포도당한천배지를 써서 측정하는 집락수를 총진균수 (TYMC)로 한다. 이 배지위에 세균의 집락이 검출되어도 TYMC로서 계산한다. 세균의 증식 때문에 TYMC가 허용기준을 넘을 것으로 예측될 때에는 항생물질을 함유하는 사부로포도당한천배지를 써도 된다. 최확수법으로 측정하는 경우에는 계산값을 TAMC로 한다. 미생물학적 품질 허용기준이 규정되어 있을 때 아래와 같이 판정한다. - 10^1 CFU : 최대허용 수 = 20 - 10^2 CFU : 최대허용 수 = 200 - 10^3 CFU : 최대허용 수 = 2000, 이하 동일 |
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
1) 서문 |
이 시험은 규정된 조건에서 검출할 수 있는 특정미생물이 존재하지 않거나 그 존재가 한정적인지를 판정하는 방법이다.
|
이 시험은 원료나 제제가 이미 정해진 미생물학적품질규격에 적합한지의 여부를 판정하는 것을 주 목적으로 한다. 채취검체수를 포함하여 지시된 방법에 따라 시험하여 결과를 판정한다. 약전시험법과의 동등성이 인정되는 경우에는 자동화법을 포함한 다른 미생물학적 방법을 적용할 수 있다.
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
2) 기본조작 |
검체의 조제는 「생균수시험」에 따른다. 검체가 항균활성이 있을 때에는 「생균수시험」에서와 같이 이 항균활성을 제거 또는 중화한다. 검체의 조제에 계면활성제를 쓸 때에는 「생균수시험」에서와 같이 미생물에 대한 독성이 없고 사용하는 불활성화제와 상호작용이 없는 것을 확인한다.
|
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
3) 배지의 성능, 시험법의 적합성 및 음성대조 가) 시험균의 조제 |
① 호기성미생물 각 세균시험용 균주를 대두카제인소화액체배지 또는 대두카제인소화한천배지에서 각각 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. 칸디다알비칸스용의 시험균주는 사부로포도당한천배지 또는 사부로 포도당액체배지에서 각각 20 ~ 25 ℃에서 2 ~ 3 일간 배양한다.
② 클로스트리디아 예를 들면 ATCC 11437 (NBRC 14293, NCIMB 12343, CIP 100651) 또는 ATCC 19404 (NCTC 532 또는 CIP 79.3)와 같은 Clostridium sporogenes를 쓴다. 클로스트리디아 시험균주를 강화 클로스트리디아배지 중에 접종하고 30 ~ 35 ℃에서 24 ~ 48 시간 혐기적 조건에서 배양한다. Cl. Sporogenes의 영양형 세포의 신선현탁액을 조제하여 희석하는 대신에 아포현탁액을 접종균액으로 사용할 수 있다. 아포현탁액은 보증된 기간 내에서는 2 ~ 8 ℃에서 보존할 수 있다. |
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
3) 배지의 성능, 시험법의 적합성 및 음성대조 나) 음성대조 |
시험조건을 확인하기 위해 검액 대신 사용한 희석액을 써서 음성대조시험을 한다. 미생물이 증식해서는 안된다.
|
음성대조는 5)항에 따른 검체시험 시에도 측정한다. 시험에 실패한 음성대조는 고찰한다.
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
3) 배지의 성능, 시험법의 적합성 및 음성대조 다) 배지의 성능시험 |
증식촉진특성시험, 액체배지
적당한 배지의 일부에 적절한 미생물을 소량 (100 CFU 이하) 접종한다. 규정된 온도에서 배양하고 배양시간은 시험법에서 규정되어 있는 배양기간 중 최단시간 이내로 한다. 유효성이 확인된 배지 배치에서 이전에 시험하여 얻은 증식과 동등한 증식을 확인한다. 증식촉진특성시험, 고체배지 각 평판배지에 적당한 미생물을 소량 (100 CFU 이하) 접종하고 한천평판도말법으로 시험한다. 규정된 온도에서 배양하고 배양시간은 시험법에 규정되어 있는 배양기간 중 최단시간 이내로 한다. 유효성이 확인된 배지 배치에서 이전에 시험하여 얻은 증식과 동등한 증식을 확인한다. 증식억제특성시험, 액체 또는 고체배지 적당한 배지에 적절한 미생물을 적어도 100 CFU 접종한다. 규정된 온도에서 배양하고 배양시간은 시험법에 규정되어 있는 배양기간 중 최장시간 이상으로 한다. 시험균의 증식이 확인되지 않는다. 감별특성시험 각 평판배지에 적당한 미생물을 소량 (100 CFU 이하) 접종하고 한천평판도말법으로 시험한다. 규정된 온도에서 배양하고 배양시간은 시험법에 규정되어 있는 배양기간의 범위 내로 한다. 집락의 형상과 감별반응은 유효성이 확인된 배지 배치에서 이전에 시험하여 얻은 것과 동등하다. |
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
3) 배지의 성능, 시험법의 적합성 및 음성대조 라) 시험법의 적합성 |
검체마다 4)항의 관련 항목에 기재되어 있는 대로 검액를 조제한다. 규정된 증균배지에 혼합할 때 각 시험균을 넣는다.
|
시험균은 개별적으로 접종한다. 접종한 시험액 중 100 CFU 이하에 해당하는 균수의 미생물을 쓴다. 4)항의 관련항목에 따라 시험한다. 다만 규정된 배양기간 중 최단시간으로 한다. 특정미생물은 4)항에 기재된 감별반응으로 검출되어야 한다. 검체의 항균활성이 인정되는 경우에는 시험방법의 변경이 필요하다 (「생균수시험」의 3) 마)③항 항균활성의 중화·제거 항 참조). 어떠한 특정검체에서 규정된 시험법으로 미생물에 대한 항균활성을 중화할 수 없는 경우에는 억제된 미생물이 그 검체 중에 존재하지 않는다고 간주해도 된다.
|
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 가) 담즙산저항성 그람음성균 |
③ 정량시험
i) 선택배양 ①항에 기재되어 있는 조제액 및/또는 그 희석액으로 각각 검체의 0.1 g, 0.01 g, 0.001 g (또는 0.1 mL, 001 mL, 0.001 mL) 해당량을 적당량의 모젤장내세균증균액체배지에 접종한다. 30 ~ 35 ℃에서 24 ~ 48 시간 배양 한 다음 바이오렛·레드·담즙산·포도당 한천배지에 각 배양액을 이식하고 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. ii) 판정 집락의 증식이 인정된 경우에는 양성으로 판정한다. 양성결과로 나타난 검체의 최소량과 음성결과로 나타난 최대량을 기재하고 표 II-2로부터 세균의 추정값을 구한다 |
① 검액 조제 및 전(前)배양
검체 1 g 이상을 달아 그 10 배 희석액을 「생균수시험」에 따라 조제하며, 이 때 희석액으로는 대두카제인소화액체배지를 써서 섞은 다음 균을 소생시키기에 충분하나 증균을 촉진시키지 않는 적절한 시간 (보통 2 시간이며 5 시간 이내) 동안 20 ~ 25 ℃에서 배양한다. ②부정시험 따로 규정되어 있지 않으면 ①항에서 조제한 검체 1 g에 해당하는 검액을 모젤장내세균증균액체배지에 접종한다. 30 ~ 35 ℃에서 24 ~ 48 시간 배양한 다음 바이올렛·레드·담즙산·포도당한천배지에 이식하고 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. 집락의 증식이 없으면 검체는 이 시험에 적합하다 |
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 나) 대장균 |
② 선택배양
용기를 흔들며 대두카제인소화액체배지의 1 mL를 맥콘키액체배지 100 mL에 넣는다. 42 ~ 44 ℃에서 24 ~ 48 시간 배양한 다음 맥콘키한천배지에 이식하고 30 ~ 35 ℃에서 18 ~ 72 시간 배양한다. |
① 검액의 조제 및 전배양
검체 1 g 이상을 취하여 「생균수시험」에 따라 조제한 10 배 희석액 10 mL 혹은 검체 1 g 또는 1 mL에 해당하는 양을 적당량 (3) 라) 시험법의 적합성에서 결정)의 대두카제인소화액체배지에 접종하고 섞은 다음 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. ③ 판정 집락의 증식이 인정될 때에는 양성으로 의심하고 동정시험으로 확인한다. 집락이 없거나 또는 동정시험에서 음성으로 판정될 때 검체는 이 시험에 적합하다. |
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 다) 살모넬라 |
② 선택배양
대두카제인소화액체배지 0.1 mL를 라파포트바시리아디스살모넬라 증균액체배지에 접종한다. 30 ~ 35 ℃에서 18 ~ 24 시간 배양한 다음 XLD 한천배지에 이식하고 30 ~ 35 ℃에서 18 ~ 48 시간 배양한다 |
① 검액 조제 및 전배양
검체 10 g 또는 10 mL를 취하여 적당량 (3) 라) 시험법의 적합성에서 결정)의 대두카제인소화액체배지에 접종하고 섞은 다음 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. ③ 판정 충분히 증식한 빨간색집락이 인정될 때에는 중심부에 흑점의 유무에 관계없이 양성으로 의심하고 동정시험으로 확인한다. 기재되어 있는 종류의 집락이 없거나 또는 동정시험에서 음성으로 판정될 때 검체는 이 시험에 적합하다 |
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 라) 녹농균 |
② 선택배양
세트리미드한천배지에 이식하고 30 ~ 35 ℃에서 18 ~ 72 시간 배양한다. |
① 검액조제 및 전배양
검체 1 g 이상을 취하고 「생균수시험」에 따라 조제한 10 배 희석액 10 mL 혹은 검체 1 g 또는 1 mL에 해당하는 양을 적당량 (3) 라) 시험법의 적합성에서 결정)의 대두카제인소화액체배지에 접종하여 섞은 다음 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. 경피흡수패취를 시험할 때는 「생균수시험」의 4) 마)①항에 기재한대로 조제하고 1 패취 해당량을 멸균멤브레인필터로 여과하고 이 멤브레인필터를 100 mL의 대두카제인소화액체배지 중에 넣는다. ③ 판정 집락의 증식이 인정될 때에는 양성으로 의심하고 동정시험으로 확인한다. 집락이 없거나 또는 동정시험에서 음성으로 판정될 때 검체는 이 시험에 적합하다 |
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 마) 황색포도상구균 |
② 선택배양
만니톨염화나트륨한천배지에 이식하고 30 ~ 35 ℃에서 18 ~ 72 시간 배양한다. |
① 검액조제 및 전배양
검체 1 g 이상을 취하여 「생균수시험」에 따라 조제한 10 배 희석액의 10 mL 혹은 1 g 또는 1 mL에 해당하는 양을 적당량 (3) 라) 시험법의 적합성에서 결정)의 대두카제인소화액체배지에 접종하여 섞은 다음 30 ~ 35 ℃에서 18 ~ 24 시간 배양한다. 경피흡수패취를 시험할 때는 「생균수시험」의 4) 마)①항에 따라 조제한 1 패취 해당량을 멸균멤브레인필터로 여과하고 이 멤브레인필터를 100 mL의 대두카제인소화액체배지 중에 넣는다. ③ 판정 노란색의 띠로 둘러싼 노란색 또는 흰색집락의 증식이 인정될 때 양성으로 의심하고 동정시험으로 확인한다. 위와 같은 종류의 집락이 없거나 또는 동정시험에서 음성으로 판정될 때 검체는 이 시험에 적합하다. |
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 바) 클로스트리디아 |
② 선택배양
각각에서 10 mL 또는 검체 1 g 또는 1 mL에 해당하는 양을 적당량 (3) 라) 시험법의 적합성에서 결정)의 강화클로스트리디아배지에 접종하여 섞은 다음 혐기적 조건으로 30 ~ 35 ℃에서 48 시간 배양한다. 배양 후 각 용기로부터 콜롬비아한천배지로 이식하고 혐기적 조건으로 30 ~ 35 ℃에서 48 시간 배양한다. |
① 검액 조제 및 가열처리
검체 2 g 또는 2 mL 이상을 취하여 「생균수시험」에 따라 10 배 희석액 (최소 20 mL 이상)을 조제한다. 조제한 검액을 최소 10 mL씩 2 개로 나눈다. 그 중 1 개는 80 ℃에서 10 분간 가열한 다음 빨리 식히고 다른 1 개는 가열하지 않는다. ③ 판정 카타라제반응양성의 간균 (아포가 있거나 또는 없는)의 혐기적 증식이 인정되는 경우 양성을 나타내며 동정시험으로 확인한다. 위와 같은 종류의 집락이 없거나 또는 동정시험에서 음성으로 판정될 때 검체는 이 시험에 적합하다. |
|
|
비무균제품의 미생물학적시험 : 특정미생물시험
4) 검체의 시험 사) 칸디다알비칸스 |
② 선택배양
사부로포도당한천배지에 이식하고 30 ~ 35 ℃에서 24 ~ 48 시간 배양한다. |
③ 판정
흰색집락의 증식이 인정될 때에는 양성으로 의심하고 동정시험으로 확인한다. 흰색집락이 없거나 또는 동정시험에서 음성으로 판정될 때 검체는 이 시험에 적합하다. |
|
|
11. 바이오오토그래프법
|
바이오오토그래프법은 여지크로마토그래프법 또는 박층크로마토그래프법을 응용하여 분리한 혼합물 중의 활성을 갖는 성분을 미생물학적 방법으로 확인하거나 또는 그 양을 측정하는 방법이다. 의약품각조의 규정 중 필요하면 참고로서 대개 함량을 %로 표시한다.
|
|
|
|
12. 박층크로마토그래프법
|
박층크로마토그래프법은 적당한 고정상으로 만든 박층을 써서 혼합물을 이동상으로 전개하여 각각의 성분으로 분리하는 방법이며 물질의 확인 또는 순도시험 등에 쓴다.
조 작 법 따로 규정이 없는 한 다음 방법에 따른다. 박층판의 아래끝에서 약 20 mm 높이의 위치를 원선으로 하고 좌우 양측에서 적어도 10 mm를 띄어서 원선 위에 의약품각조에서 규정하는 양의 검액 및 표준액을 마이크로피펫 등을 써서 약 10 mm 이상의 적당한 간격으로 지름 2 ~ 6 mm의 원형상으로 점적하고 바람에 말린다. 다음에 따로 규정이 없는 한 미리 전개조의 안쪽 벽을 따라 여지를 두르고 여지를 전개용매로 적시고 다시 전개용매를 약 10 mm의 깊이로 넣어 전개조를 밀폐하여 상온에서 약 1 시간 방치하고 여기에 박층판을 기벽에 닿지 않도록 넣고 전개조를 밀폐하여 상온에서 전개한다. 전개용매의 선단이 원선으로부터 의약품각조에서 규정하는 거리까지 전개하였을 때 박층판을 꺼내어 곧 용매의 선단 위치를 표시하고 바람에 말린 다음 의약품각조에서 규정하는 방법에 따라 검액 및 표준액의 각 반점의 Rf 값, 색 등을 비교한다. 다음 식에 따라 Rf 값을 구한다. Rf = 원선에서 반점의 중심까지의 거리 / 원선에서 용매선단까지의 거리 |
박층판의 조제
보통 다음 방법에 따른다. 5 cm × 20 cm 또는 20 cm × 20 cm의 평활하고 두께가 고른 유리판을 써서 그 한 면에 의약품각조에서 규정하는 고정상 고체의 가루를 물에 현탁한 액을 적당한 기구를 써서 0.2 ~ 0.3 mm의 두께로 고르게 도포한다. 바람에 말린 다음 105 ~ 120 ℃ 사이의 일정한 온도에서 30 ~ 60 분간 가열건조하여 박층판을 만든다. 유리판 대신 적당한 플라스틱판을 쓸 수 있다. 박층판은 습기를 피하여 보존한다. |
|
|
13. 발열성물질시험법
|
발열성물질시험법은 발열성물질의 존재를 토끼를 써서 시험하는 방법이다.
판 정 제 1 회 시험에는 시험동물 3 마리를 쓴다. 최고체온이 대조체온보다 적을 경우의 체온상승은 0 ℃로 한다. 체온상승 0.5 ℃ 이상인 시험동물이 없을 때는 발열성물질 음성으로 판정하고 발열성물질이 음성일 때는 적합으로 한다. 체온상승 0.5 ℃ 이상인 시험동물이 있을 때는 시험을 다시 한다. 제 2 회 시험에는 시험동물 5 마리를 쓰고 제 1 회 및 제 2 회 시험에 쓴 8 마리의 시험동물 중 체온상승 0.5 ℃ 이상인 시험동물이 3 마리 이하이고, 8 마리의 체온상승의 합계가 3.3 ℃ 이하일 때는 발열성물질 음성으로 판정하고 발열성물질이 음성일 때는 적합으로 한다 |
시험동물
건강하고 체중 1.5 kg 이상의 토끼로 사용전 1주간 이상은 일정한 사료로 사육하고 체중이 감소하지 않은 것을 시험동물로 쓴다. 토끼는 한 마리씩 동물장에 넣고 흥분하지 않도록 자극이 없는 환경에서 사육한다. 시험전 48시간 이상 및 시험 중에는 실온을 20 ~ 27℃의 범위 내에서 일정하게 유지한다. 처음으로 시험에 쓰는 토끼는 시험전 1 ~ 3일간 이내에 주사를 제외한 전 조작이 포함된 플라시보시험을 하여 시험에 적응시킨다. 시험에 쓴 토끼를 다시 사용하는 경우에는 48시간 이상 휴양시킨다. 단 발열성 물질 양성으로 판정된 검체를 투여한 토끼 또는 그 이전에 피검체와 공통인 항원물질을 함유하는 검체를 투여한 토끼는 재사용하지 않는다. 장치 및 기구 1) 온도계 측정온도 ± 0.1 ℃이내의 직장온도계 또는 체온측정장치를 쓴다. 2) 주사기 및 주사바늘 발열성 물질 제거 처리로서 보통 250 ℃에서 30 분 이상 건열처리한 것을 쓴다. 또는 멸균을 한 주사침이 있는 플라스틱제의 주사기로서 발열성물질이 검출되지 않고 발열성 물질시험에 대한 간섭작용이 없는 것이 확인된 것을 쓴다. 조 작 법 1) 시험용량 따로 규정이 없는 한 시험동물 체중 1 kg당 검액 10 mL로 한다. 2) 방 법 시험은 사육실과 같은 실온인 실험실에서 하며 자극이 없는 환경에서 한다. 사료는 대조체온측정의 수 시간 전부터 시험종료까지 주지 않는다. 시험동물은 보통 자연스러운 앉은 자세를 할 수 있는 목을 채우는 고정기에 고정한다. 체온은 직장체온계 또는 측정장치의 온도측정부분을 직장 내에 60 ~ 90 mm의 범위 내에서 일정한 깊이로 삽입하여 측정한다. 시험동물이 안정되었을 때 체온을 읽어 대조체온으로 하고 30 분 이내에 검액을 주사한다. 검액을 주사할 시험동물간 대조체온의 차이는 1 ℃ 이하이어야 하고, 대조체온의 값이 39.8 ℃보다 높은 시험동물은 시험에 쓰지 않는다. 검액은 37 ± 2 ℃로 가온하고 시험동물의 귀정맥에 서서히 주사한다. |
|
|
14. 분말 X 선 회절측정법
|
분말 X 선 회절측정법은 분말검체에 X 선을 조사하여 그 물질 중의 전자를 강제 진동시켜 생기는 간섭성 산란 X 선의 회절강도를 각 회절각에서 측정하는 방법이다. 화합물의 전체의 결정상은 특징적인 X 선 회절 패턴을 나타낸다. X 선 회절 패턴은 미세결정(crystallite) 또는 어느 정도의 크기의 결정편으로 된 무배향화된 결정성분말에서 얻는다. 단위격자의 종류와 크기에 의존하는 회절선의 각도 주로 원자의 종류와 배열 및 검체 중의 입자배향에 의존하는 회절선의 강도 및 측정장치의 해상력과 미세결정의 크기, 변형 (strain) 및 검체의 두께에 의존하는 회절선의 형상 등 3 종류의 정보를 보통 X 선 회절 패턴으로부터 얻는다. 회절선의 각도 및 강도의 측정은 결정성물질의 결정모양의 확인과 같은 정성적 및 정량적인 상 분석에 응용할 수 있다. 또 무정형과 결정의 비율의 평가도 가능하다. 분말 X 선 회절측정법은 다른 분석방법과 달리 비파괴적인 측정법이다 (검체조제는 검체의 무배향을 보증하기 위한 분쇄에 한한다). 분말 X 선 회절측정법은 저온·저습 또는 고온·고습과 같은 특별한 조건에서도 가능하다.
|
|
|
|
15. 불꽃반응시험법
|
불꽃반응시험법은 어떤 종류의 원소가 예민하게 분젠버너의 무색 불꽃 중에서 각각의 고유한 색을 나타내는 성질을 이용하여 그 원소를 확인하는 시험법이다.
|
1) 금속염의 불꽃반응
시험에 쓰는 백금선은 지름 약 0.8 mm이며 끝은 직선 그대로 쓴다.검체가 고체일 때에는 염산 소량을 넣어 이상 (泥狀)으로 만들어 그 소량을 백금선의 끝에서 약 5 mm 부분까지 묻혀 수평으로 유지하여 무색 불꽃 속에 넣어 시험한다. 또 검체가 액체인 경우에는 백금선의 끝을 검체 속에 약 5 mm 담근 다음 가만히 끌어올려 고체의 경우와 같은 방법으로 시험한다. 2) 할로겐화합물의 불꽃반응 지름 0.174 mm인 구리선으로 간격이 0.25 mm 되게 만든 구리망을 폭 약 1.5 cm, 길이 약 5 cm로 잘라 구리선의 한쪽 끝에 감는다. 이것을 분젠버너의 무색 불꽃 속에서 불꽃이 초록색 또는 파란색을 나타내지 않을 때까지 강열한 다음 식히고 이 조작을 여러 번 반복하여 산화구리의 피막을 완전히 입힌다. 식힌 다음 이 구리망 위에 따로 규정이 없는 한 검체 1 mg을 묻혀 점화하고 연소시킨다. 이 조작을 3 회 반복한 다음 구리망을 무색 불꽃 속에 넣어 시험한다.불꽃반응이 지속한다라고 함은 그 반응이 약 4 초 동안 지속하는 것을 말한다. |
|
|
16. 불용성이물시험법
|
불용성이물시험법은 점안제 및 주사제 중 불용성이물의 유무를 확인하는 시험법이다.
점 안 제 수용액인 점안제 및 쓸 때 녹여 쓰는 점안제의 수성용제는 흰색광원을 써서 3000 ~ 5000 럭스 밝기의 위치에서 육안으로 관찰할 때 맑으며 쉽게 검출되는 불용성이물이 없다. 주 사 제 제 1 법 용액인 주사제 및 쓸 때 녹여 쓰는 주사제의 용제는 용기의 바깥쪽을 깨끗이 닦고 흰색광원 바로 아래 약 1000 럭스 밝기의 위치에서 육안으로 관찰할 때 맑으며 쉽게 검출되는 불용성이물이 없다. 다만 플라스틱제수성주사제용기를 쓴 이 제제에서는 위 및 아래에 흰색광원을 써서 8000 ~ 10000 럭스 밝기의 위치에서 육안으로 관찰한다. 제 2 법 쓸 때 녹여 쓰는 주사제는 용기의 바깥쪽을 깨끗이 닦고 이물이 들어가지 않도록 충분히 조심하여 첨부한 용제 또는 주사용수를 써서 녹이고 흰색광원 바로 아래 약 1000 럭스 밝기의 위치에서 육안으로 관찰할 때 맑으며 분명히 볼 수 있는 불용성이물이 없다. |
|
|
|
17. 붕해시험법
|
붕해시험법은 정제, 캡슐제, 과립제, 환제, 좌제가 시험액 중에서 정해진 조건에서 규정시간 안에 붕해하는가를 확인하는 시험법이다. 붕해시험법은 제제중의 유효성분이 완전히 용해하는가를 확인하는 것은 아니다.
|
|
|
|
17. 붕해시험법
장 치 |
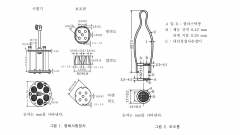
|
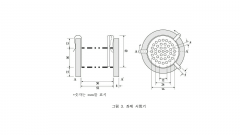
|
|
|
17. 붕해시험법
시 험 액 |
1) 제 1액
염화나트륨 2.0 g에 염산 7.0 mL 및 물을 넣어 녹여 1000 mL로 한다. 이 액은 무색투명하고 그 pH는 약 1.2 이다. 2) 제 2액 0.2 mol/L 인산이수소칼륨시액 250 mL에 0.2 mol/L 수산화나트륨시액 118 mL 및 물을 넣어 1000 mL로 한다. 이 액은 무색투명하고 그 pH는 약 6.8 이다. 3) 물 |
|
|
|
17. 붕해시험법
조 작 법 1) 일반방출제제 |
정제, 캡슐제, 환제 (생약을 함유하는 환제는 제외)에 대하여는 시험기 6개의 유리관 각각에 검체 1개씩을 넣고 보조판의 사용이 규정되어 있는 경우에는 보조판을 넣고 따로 규정이 없는 한 시험액으로 물을 써서 37 ± 2 ℃에서 시험기를 작동시킨다. 검체가 시험액에 뜨는 경우 시험기 위의 플라스틱판의 윗면에 체눈의 간격이 1.8 ~ 2.2 mm, 선재의 지름이 0.57 ~ 0.66 mm 의 평평한 스테인레스강 망을 써서 시험할 수 있다. 따로 규정이 없는 한 정제는 30 분 후, 코팅정제 및 환제는 60 분 후, 캡슐제는 20 분 후에 시험기를 시험액에서 꺼내어 검체의 붕해 양상을 관찰한다. 검체의 잔류물이 유리관 안에 없든가 있더라도 분명하게 원형을 나타내지 않는 연질의 물질일 때, 또는 불용성의 제피 또는 캡슐 피막의 단편일 때 검체는 붕해된 것이다. 모든 검체가 붕해되었을 때 적합하다. 1 개 또는 2 개가 붕해되지 않았을 때는 다시 12 개의 검체를 가지고 시험을 하고 총 18 개의 검체 중 16 개 이상의 검체가 붕해되었을 때 적합한 것으로 한다.
|
생약을 함유한 환제에 대하여는 시험액으로 제1액을 써서 같은 방법으로 60 분간 시험을 한다. 검체의 잔류물이 유리관 안에 있으면 계속하여 제 2 액으로 60 분간 시험한다.
과립제에 대하여는 30 호 체 (500 μm)를 써서 제제의 입도시험법 1)의 규정에 따라 체로 쳐서 30호 체에 잔류한 검체 0.10 g씩을 각각 보조통 6 개에 넣고 보조통을 시험기의 유리관에 1개씩 넣어 고정하고 따로 규정이 없는 한 시험액으로 물을 써서 37 ± 2 ℃에서 시험기를 작동한다. 따로 규정이 없는 한 코팅을 하지 않는 과립은 30 분 후, 코팅을 한 과립은 60 분 후에 시험기를 시험액에서 끌어올려 보조통을 꺼내어 검체의 붕해 양상을 관찰한다. 검체의 잔류물이 보조통 안에 없거나. 있더라도 명확하게 원형을 나타내지 않는 연질의 물질일 때, 또는 제피의 단편일 때 붕해된 것이다. 모든 보조통 내의 검체가 붕해되었을 때 적합하다. 1 개 또는 2 개의 보조통 안의 검체가 붕해되지 않았을 때는 다시 12 개의 검체를 가지고 시험을 하고 총 18 개의 검체 중 16 개 이상의 검체가 완전히 붕해되었을 때 적합한 것으로 한다. |
|
|
17. 붕해시험법
조 작 법 2) 장용성제제 |
ⅰ) 장용정 및 장용성캡슐
가. 제1액에 의한 시험 시험액으로 제1액을 써서 120 분 간 일반방출제제의 조작법에 따라 시험한다. 장용정 및 장용성캡슐이 붕해된 때, 또는 장용성피막이 개구되거나 파손된 때 붕해된 것이다. 모든 검체가 붕해되지 않았을 때 적합하다. 1 개 또는 2 개가 붕해된 때는 다시 12 개의 검체를 가지고 시험을 하고 총 18 개의 검체 중 16 개 이상의 검체가 붕해되지 않았을 때 적합으로 한다. 나. 제2액에 의한 시험 시험액으로 제2액을 써서 60 분간 일반방출제제의 조작법에 따라 시험하여 붕해 여부를 판정한다. ⅱ ) 장용과립 및 장용과립을 충전한 캡슐제 과립제 또는 캡슐제 속에서 빼낸 내용물을 30호 체 (500 μm)을 써서제제의 입도시험법 1) 과립제 규정에 따라 체로 쳐서 30 호 체 위에 잔류하는 검체 0.10 g씩을 각각 보조통 6 개에 넣고 보조통을 시험기의 유리관에 1 개 씩 넣어 고정하고 가. 제 1 액에 의한 시험 및 나. 제 2 액에 의한 시험 등 두 번의 시험을 한다. 가. 제1액에 의한 시험 시험액으로 제 1 액을 써서 60 분간 일반방출제제의 조작법에 따라 시험한다. 시험기의 망목으로부터 떨어지는 과립수가 15개 이내일 때 적합하다. 나. 제2액에 의한 시험 시험액으로 제 2 액을 써서 30 분간 속방성제제의 조작법에 따라 시험하여 붕해의 적부를 판정한다. |
|
|
|
17. 붕해시험법
조 작 법 |
물을 시험액으로 하여 좌제를 아래 디스크에 놓고 슬리브에 장착하고 시험기를 약 36 ℃, 4000 mL이상의 용기 3 개에 각각 1 개씩 넣거나 12 L 이상의 용기에는 3 개를 한꺼번에 넣는다. 물은 천천히 움직이도록 하면서 수면 아래 90 mm에 장치를 고정시켜 10 분마다 뒤집되 수면 위로 올라오지 않도록 한다. 따로 규정이 없는 한 지용성 좌제는 30 분, 수용성 좌제는 60 분이내 연화되거나 붕해되어 다음에 해당되는 경우 적합하다. ① 완전히 녹는 경우, ② 성분이 분리된 경우에 용융된 지방성분은 용액의 표면으로 모여 있고 불용성 가루는 바닥으로 떨어지고 가용성분은 녹은 경우, ③ 성분이 완전히 분리되지 않고 상당한 변형이 있거나 유리막대로 힘을 가했을 때 저항을 나타내는 고형 덩어리가 없는 경우이다.
|
|
|
|
18. 비소시험법
|
비소시험법은 의약품 중에 혼재하는 비소의 한도시험이다. 그 한도는 삼산화비소 (As2O3)의 양으로 나타낸다.
의약품각조에서는 비소 (As2O3로서)의 한도를 ppm으로 ( ) 안에 나타낸다. |
|
|
|
18. 비소시험법
장 치 |
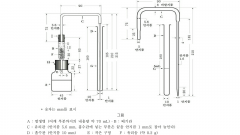
|
|
|
|
18. 비소시험법
검액의 조제법 |
제 1 법
의약품각조에서 규정하는 양의 검체를 달아 물 5 mL를 넣고 필요하면 가온하여 녹여 검액으로 한다. 제 2 법 의약품각조에서 규정하는 양의 검체를 달아 물 5 mL 및 황산 1 mL를 넣는다. 다만 무기산의 경우에는 황산을 넣지 않는다. 여기에 아황산수 10 mL를 넣고 작은 비커에 넣어 수욕에서 가열하여 아황산이 없어지고 약 2 mL가 될 때까지 증발시키고 물을 넣어 5 mL로 하여 검액으로 한다. 제 3 법 의약품각조에서 규정하는 양의 검체를 달아 백금제, 석영제 또는 사기제 도가니에 넣는다. 여기에 질산마그네슘의 에탄올용액(1 → 50) 10 mL를 넣어 에탄올에 점화하여 연소시킨 다음 천천히 가열하여 회화시킨다. 만일 이 방법으로 탄화물이 남아 있을 때는 소량의 질산으로 적시고 다시 강열하여 회화한다. 식힌 다음 잔류물에 염산 3 mL를 넣어 수욕에서 가온하여 녹여 검액으로 한다. 제 4 법 의약품각조에서 규정하는 양의 검체를 달아 백금제, 석영제 또는 사기제 도가니에 넣는다. 여기에 질산마그네슘의 에탄올용액(1 → 10) 10 mL를 넣어 에탄올에 점화하여 연소시킨 다음 천천히 가열하고 강열하여 회화시킨다. 만일 이 방법으로 탄화물이 남아있을 때는 소량의 질산으로 적시고 천천히 가열한 다음 강열하여 회화시킨다. 식힌 다음 잔류물에 염산 3 mL를 넣어 수욕에서 가온하여 녹여 검액으로 한다. 제 5 법 의약품각조에서 규정하는 양의 검체를 달아 N,N-디메틸포름아미드 10 mL를 넣어 가온하여 녹여 검액으로 한다. |
|
|
|
18. 비소시험법
시 액 |
1) 비화수소흡수액
N,N-디에틸디티오카르밤산은 0.50 g을 피리딘에 녹여 100 mL로 한다. 이 액은 차광하여 마개가 달린 병에 넣어 냉소에 보관한다. 2) 비소표준원액 삼산화비소를 미세말로 하여 105 ℃에서 4 시간 건조하여 0.100 g을 정확하게 달아 수산화나트륨용액(1 → 5) 5 mL에 녹인다. 이 액에 묽은황산을 넣어 중성으로 하고 다시 묽은황산 10 mL를 더 넣고 새로 끓여 식힌 물을 넣어 정확하게 1000 mL로 한다. 3) 비소표준액 비소표준원액 10 mL를 정확하게 취하여 묽은황산 10 mL를 넣고 새로 끓여 식힌 물을 넣어 정확하게 1000 mL로 한다. 이 액 1 mL는 삼산화비소 (As2O3) 1 μg을 함유한다. 이 액은 쓸 때 만들어 마개가 달린 병에 보관한다. |
|
|
|
18. 비소시험법
조 작 법 |
따로 규정이 없는 한 다음 방법에 따라 시험한다. 표준색의 조제는 동시에 한다.
발생병 A에 검액을 취하여 필요하면 소량의 물로 씻어 넣고 이 액에 메틸오렌지시액 1 방울을 넣고 암모니아시액, 암모니아수(28) 또는 묽은염산을 써서 중화시킨 다음 희석시킨 염산(1 → 2) 5 mL 및 요오드화칼륨시액 5 mL를 넣어 2 ~ 3 분간 방치한 다음 다시 산성염화주석(II)시액 5 mL를 넣고 실온에서 10 분간 방치한다. 다음에 물을 넣어 40 mL로 하고 비소분석용아연 2 g을 넣고 곧 B 및 C를 연결한 고무마개 H를 발생병 A에 끼운다. C의 세관부 끝은 미리 비화수소흡수액 5 mL를 넣은 흡수관 D의 밑에까지 닿도록 넣어 둔다. 다음에 발생병 A를 25 ℃의 물속에 어깨까지 잠기게 넣어 1 시간 방치한다. 흡수관을 꺼내고 필요하면 피리딘을 넣어 5 mL로 하고 흡수액의 색을 관찰한다. 이 색은 표준색보다 진하지 않다. |
표준색의 조제
발생병 A에 비소표준액 2 mL를 정확하게 넣고 다시 희석시킨 염산(1 → 2) 5 mL 및 요오드화칼륨시액 5 mL를 넣어 2 ~ 3 분간 방치한 다음 산성염화제일석시액 5 mL를 넣고 실온에서 10 분간 방치한다. 이하 앞에서와 같은 방법으로 조작하여 얻은 흡수액의 정색을 표준색으로 한다. 이 색은 삼산화비소 (As2O3) 2 μg에 해당한다. 주의 시험에 쓰는 기구, 시약 및 시액은 비소를 함유하지 않거나 거의 함유하지 않은 것을 쓰고 필요하면 공시험을 한다. |

