![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
172 Cards in this Set
- Front
- Back
|
Cuál carbono es el del N-terminal? |
Todos los aminoácidos se leen de izquia derecha, por ende siempre será el primer carbono |
|
|
Cuál es el carbono alfa de un ámino ácido? |
El carbono que presenta 4 enlaces covalentes con 4 moléculas distintas, la cadena lateral, grupo carboxilo, grupo amino y un hidrógeno |
|
|
Qué contiene la información (secuencia de nucleótidos) con información de la síntesis de proteínas? |
El código genético |
|
|
De qué depende la forma tridimensional de una proteína? |
De sus aminoácidos |
|
|
Cuáles son los aminoácidos con grupos R polares con carga negativa? |
Aspartato y Glutamato |
|
|
Cuáles son los aminoácidos con grupos R polares con carga positiva? |
Lisina, Arginina e Histidina |
|
|
Como se unen aminoácidos? |
A través de enlaces peptídicos |
|
|
Que compone un enlace peptídico? |
Entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amino (-NH2/3) del segundo aminoácido |
|
|
Cuál es la característica física del enlace peptídico? |
Muy estable y muy rígido, toma mucha energía para romperlo, su rigidez no permite giro de sus subproductos elementos |
|
|
Qué son péptidos? |
Moléculas formadas por amác unidos por enlaces péptidicos |
|
|
Cómo se pueden clasificar los péptidos? |
Según su peso molecular (n*amác<100, peso Mol>5000Dal -> proteínas) y según su cantidad de aminoácidos (entre 2 a 100 son péptidos, más de 100 es proteína) |
|
|
Cuál es la unidad estructural de las proteínas? |
Los aminoácidos |
|
|
Cuántas combinaciones de aminoácidos existen en el código genético? |
20, las secuencias de nuecleótidos contienen las información para la síntesis de proteínas |
|
|
Cuál es el órden en trans___ de las proteínas? |
Transcripción -> mRNA -> Traducción -> Proteína |
|
|
Qué le da identidad al aminoácido? |
Su cadena lateral |
|
|
Qué grupos funcionales componen a un aminoácido? |
Un grupo amino y un grupo carboxilo unidos al mismo carbono |
|
|
Cuáles son los aminoácidos con grupo R alifático no polar? |
Glicina, Alanina, Valina, Leucina, Metionina, Isoleucina, Prolina |
|
|
Como es la composición de los aminoácidos con grupo R alifático no polar? |
Sus R solo tienen C y H, excepto la metionina que contiene S (pero mantiene su apolaridad) |
|
|
Cuáles son los aminoácidos con grupo R aromático no polar? |
La fenilalanina, tirosina y triptófano |
|
|
Cuáles son los aminoácidos con Grupo R polares sin carga? |
Los que contienen átomos electronegativos en sus R, como la cistina, la serina, la treonina, la asparagina y la glutamina |
|
|
De qué depende la forma tridimensional de una proteína? |
De sus aminoácidos |
|
|
Cuáles son los aminoácidos con grupos R polares con carga negativa? |
Aspartato y Glutamato |
|
|
Cuáles son los aminoácidos con grupos R polares con carga positiva? |
Lisina, Arginina e Histidina |
|
|
Como se unen aminoácidos? |
A través de enlaces peptídicos |
|
|
Que compone un enlace peptídico? |
Entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amino (-NH2/3) del segundo aminoácido |
|
|
Cuál es la característica física del enlace peptídico? |
Muy estable y muy rígido, toma mucha energía para romperlo, su rigidez no permite giro de sus subproductos elementos |
|
|
Qué son péptidos? |
Moléculas formadas por amác unidos por enlaces péptidicos |
|
|
Cómo se pueden clasificar los péptidos? |
Según su peso molecular (n*amác<100, peso Mol>5000Dal -> proteínas) y según su cantidad de aminoácidos (entre 2 a 100 son péptidos, más de 100 es proteína) |
|
|
Qué es un residuo de aminoácidos? |
“Lo que quedó” del aminoácido tras formar el enlace |
|
|
Cuál es la unidad estructural de las proteínas? |
Los aminoácidos |
|
|
Cuántas combinaciones de aminoácidos existen en el código genético? |
20, las secuencias de nuecleótidos contienen las información para la síntesis de proteínas |
|
|
Cuál es el órden en trans___ de las proteínas? |
Transcripción -> mRNA -> Traducción -> Proteína |
|
|
Qué le da identidad al aminoácido? |
Su cadena lateral |
|
|
Qué grupos funcionales componen a un aminoácido? |
Un grupo amino y un grupo carboxilo unidos al mismo carbono |
|
|
Cuáles son los aminoácidos con grupo R alifático no polar? |
Glicina, Alanina, Valina, Leucina, Metionina, Isoleucina, Prolina |
|
|
Como es la composición de los aminoácidos con grupo R alifático no polar? |
Sus R solo tienen C y H, excepto la metionina que contiene S (pero mantiene su apolaridad) |
|
|
Cuáles son los aminoácidos con grupo R aromático no polar? |
La fenilalanina, tirosina y triptófano |
|
|
Cuáles son los aminoácidos con Grupo R polares sin carga? |
Los que contienen átomos electronegativos en sus R, como la cistina, la serina, la treonina, la asparagina y la glutamina |
|
|
De qué depende la forma tridimensional de una proteína? |
De sus aminoácidos |
|
|
Cuáles son los aminoácidos con grupos R polares con carga negativa? |
Aspartato y Glutamato |
|
|
Cuáles son los aminoácidos con grupos R polares con carga positiva? |
Lisina, Arginina e Histidina |
|
|
Como se unen aminoácidos? |
A través de enlaces peptídicos |
|
|
Que compone un enlace peptídico? |
Entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amino (-NH2/3) del segundo aminoácido |
|
|
Cuál es la característica física del enlace peptídico? |
Muy estable y muy rígido, toma mucha energía para romperlo, su rigidez no permite giro de sus subproductos elementos |
|
|
Qué son péptidos? |
Moléculas formadas por amác unidos por enlaces péptidicos |
|
|
Cómo se pueden clasificar los péptidos? |
Según su peso molecular (n*amác<100, peso Mol>5000Dal -> proteínas) y según su cantidad de aminoácidos (entre 2 a 100 son péptidos, más de 100 es proteína) |
|
|
Qué es un residuo de aminoácidos? |
“Lo que quedó” del aminoácido tras formar el enlace |
|
|
Cuál es la diferencia entre oligopéptidos y polipéptidos? |
La cantidad de residuos de amác, oligo: pocos, poli: muchos |
|
|
Cuál es la unidad estructural de las proteínas? |
Los aminoácidos |
|
|
Cuántas combinaciones de aminoácidos existen en el código genético? |
20, las secuencias de nuecleótidos contienen las información para la síntesis de proteínas |
|
|
Cuál es el órden en trans___ de las proteínas? |
Transcripción -> mRNA -> Traducción -> Proteína |
|
|
Qué le da identidad al aminoácido? |
Su cadena lateral |
|
|
Qué grupos funcionales componen a un aminoácido? |
Un grupo amino y un grupo carboxilo unidos al mismo carbono |
|
|
Cuáles son los aminoácidos con grupo R alifático no polar? |
Glicina, Alanina, Valina, Leucina, Metionina, Isoleucina, Prolina |
|
|
Como es la composición de los aminoácidos con grupo R alifático no polar? |
Sus R solo tienen C y H, excepto la metionina que contiene S (pero mantiene su apolaridad) |
|
|
Cuáles son los aminoácidos con grupo R aromático no polar? |
La fenilalanina, tirosina y triptófano |
|
|
Cuáles son los aminoácidos con Grupo R polares sin carga? |
Los que contienen átomos electronegativos en sus R, como la cistina, la serina, la treonina, la asparagina y la glutamina |
|
|
De qué depende la forma tridimensional de una proteína? |
De sus aminoácidos |
|
|
Cuáles son los aminoácidos con grupos R polares con carga negativa? |
Aspartato y Glutamato |
|
|
Cuáles son los aminoácidos con grupos R polares con carga positiva? |
Lisina, Arginina e Histidina |
|
|
Como se unen aminoácidos? |
A través de enlaces peptídicos |
|
|
Que compone un enlace peptídico? |
Entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amino (-NH2/3) del segundo aminoácido |
|
|
Cuál es la característica física del enlace peptídico? |
Muy estable y muy rígido, toma mucha energía para romperlo, su rigidez no permite giro de sus subproductos elementos |
|
|
Qué son péptidos? |
Moléculas formadas por amác unidos por enlaces péptidicos |
|
|
Cómo se pueden clasificar los péptidos? |
Según su peso molecular (n*amác<100, peso Mol>5000Dal -> proteínas) y según su cantidad de aminoácidos (entre 2 a 100 son péptidos, más de 100 es proteína) |
|
|
Qué es un residuo de aminoácidos? |
“Lo que quedó” del aminoácido tras formar el enlace |
|
|
Cuál es la diferencia entre oligopéptidos y polipéptidos? |
La cantidad de residuos de amác, oligo: pocos, poli: muchos |
|
|
Que tienen en su R los aminoácidos polares con carga negativa? |
Un grupo carboxilo |
|
|
Cuál es la unidad estructural de las proteínas? |
Los aminoácidos |
|
|
Cuál es la relación ácido-base con los aminoácidos polares de cargas positiva y negativa? |
Los con carga negativa son ácidos, los positivos bases |
|
|
Qué se encuentra en los aminoácidos polares con carga positiva? |
Un grupo sulfidrilo capaz de formar enlaces disulfuro |
|
|
Cuáles son tres ejemplos de aminoácidos no estándares? |
para la coagulación, el glutamato pasa a y-carboxiglutamato (agrega un COO-), la miosina se vuelve 6-N-Metilisina (al agregar un CH3) y en el colágeno la 4-hidroxipolina se vuelve 5-hidroxilisina (+ un OH) |
|
|
Qué es un pentapéptido? |
Un ejemplo de oligopéptido con 5 péptidos, como el seril-glicil-tirosil-alanil-leucina |
|
|
Como se ve químicamente el enlace peptídico? |
H | C — N || O |
|
|
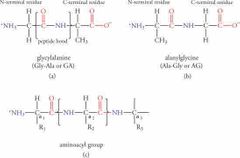
Cuál carbono es el del N-terminal? |
Todos los aminoácidos se leen de izquia derecha, por ende siempre será el primer carbono |
|
|
Cuáles son 5 tipos de mecanismos de señalización funcionales por péptidos? |
La oxitocina (9 residuos), Bradquimina (9 residuos), Insulina (2 cadenas polipéptidicas, una de 30 residuos y la otra de 21), el factor liberador de tirotropina (3 residuos) y el Glucagón (20 residuos) |
|
|
Cuál es el tamaño promedio de las proteínas? (en residuos) |
En promedio unos 2000 residuos, sin embargo hay una gran variedad, como el citocromo c con 104 vs el titin con 27000 residuos |
|
|
Cuál es la estructura de gran parte de las proteínas? |
Formadas por más de una cadena polipeptídica que interactuan de forma no covalente o covalente, como por ejemplo, con puentes disulfuro |
|
|
Qué son las “subunidades”? |
Cadenas polipeptídicas |
|
|
Cuántas combinaciones de aminoácidos existen en el código genético? |
20, las secuencias de nuecleótidos contienen las información para la síntesis de proteínas |
|
|
Qué y cómo ocurre cuando las cadenas de una proteína se hidrolizan? |
Estas se rompen, es decir se desnaturalizan, ocurre a través de pHs muy altos o temperaturas muy altas |
|
|
Composición de las subunidades de la hemoglobina |
Tiene 4 subunidades, dos de ellas son alfa, dos son beta, lo cual la hace un heterotetrámero |
|
|
Como ocurren los puentes disulfuro? |
A través de la oxidación del grupo sulfidrilo de dos moléculas de cisteína SH —> S |
|
|
Qué es una proteína conjugada? |
Un tipo donde además de aminoácidos hay otros grupos químicos, esta parte no aminoácidica se llama grupo prostético |
|
|
Para qué son importantes los grupos prostéticos? |
Para la función biológica de la proteína |
|
|
Cuáles son 3 tipos de proteínas conjugadas y cuál es un ejemplo de uno de ellos |
Las lipoproteínas, las glicoproteínas y las metaloproteínas, como la hemoglobina, que tiene un átomo de hierro (en un anillo en el centro) como su grupo prostético, también llamada una proteína del grupo heme |
|
|
Cuáles son los niveles estructurales de las proteínas? |
Primario, secundario, terciario y cuaternario |
|
|
En qué consiste la estructura primaria de una proteína? |
En los residuos de aminoácidos |
|
|
En qué consiste la estructura secundaria de una proteína? |
Es el primer nivel estructural tridimensional, el más común es el alfa helix. Ocurre cuando los aminoácidos en la secuencia interactúan a través de enlaces de hidrógeno (puentes) |
|
|
En qué consiste la estructura terciaria de una proteína? |
En la cadena de polipéptidos. Es un plegamiento tridimensional de la proteína debido a las interacciones entre sus cadenas laterales , ciertas atracciones entre las hélices alfa o las láminas beta. Los “dominios” se forman aquí |
|
|
Cuál es el órden en trans___ de las proteínas? |
Transcripción -> mRNA -> Traducción -> Proteína |
|
|
Cuál es la estructura cuaternaria de una proteína? |
Son las subunidades ensambladas. La asociación de dos o más estructuras terciarias gracias a las chaperonas |
|
|
Que estructura determina la estructura tridimensional de una proteína? |
Su secuencia primaria de aminoácidos |
|
|
De qué depende la función de una proteína? |
De su estructura |
|
|
Qué fuerzas estabilizan la mayoría de las estructuras terciarias? |
No covalentes |
|
|
A qué se le llama conformación? |
Al arreglo espacial de átomos |
|
|
Qué es la conformación nativa? |
El estado de mayor estabilidad de una proteína en su entorno fisiológico ideal. Depende de las interacciones hidrofóbicas y electroestáticas, los puentes de hidrógeno y los de disulfuro |
|
|
Hacia dónde se orientan los residuos de aminoácidos hidrofóbicos/apolares? |
Hacia el interior/el centro de la proteína, lejos del agua |
|
|
Qué estabiliza las hélice alfa? |
Los puentes de hidrógeno |
|
|
En qué consiste la conformación Beta? |
En un tipo de estructura secundaria donde el esqueleto (conformación local de una parte del polipeptido) toma forma de zig zag formando plisados. Sólo grupos R pequeños pueden formar estas. |
|
|
Cuáles son las clasificaciones según forma de las proteínas? |
Las fibrosas, abundan en estructuras que dan soporte, forma y protección externa (ej colágeno: 35% glicina, 11% alanina, 21% prolina e hidroxipolina) y las globulares, que consisten en la mayoría de las enzimas y proteínas reguladoras del metabolismo |
|
|
Qué le da identidad al aminoácido? |
Su cadena lateral |
|
|
Cómo ayudan las chaperonas/chaperoninas en la estructura proteíca? |
Algunas proteínas pueden adquirir su configuración terciaria gracias a la ayuda en plegar a medida que se sintetizan que proveen |
|
|
Cuál es un ejemplo de defecto en el plegamiento de proteínas? |
Priones/la proteína prion (28000Dal), en bovinos se llama “vacas locas” y en humanos “Creutzfeldt-Jakob”, provoca encefalopatías enpongiformes que suelen ser fatales |
|
|
Qué es un multímero y un olígomero? |
Un multímero es una proteína con 2 hasta 100 subunidades (una proteína con estructura cuaternaria) se llaman olígomeros cuando tiene pocas subunidades |
|
|
En qué consiste la pérdida de conformación de la hemoglobina? |
Ocurre en la anemia falciforme donde el glóbulo rojo se vuelve puntiagudo y alargado, taponeando capilares y rompiendolos, creando hemorragias. Ocurre por la mutación de la subunidad beta donde un residuo de glutamato (polar) se cambia por un aminoácido apolar, lo cual altera la estructura terciaria (es decir, la forma en que las beta hablan entre sí) formando fibrillas que llenan y cambian la forma del glóbulo |
|
|
Qué grupos funcionales componen a un aminoácido? |
Un grupo amino y un grupo carboxilo unidos al mismo carbono |
|
|
Cuáles son los aminoácidos con grupo R alifático no polar? |
Glicina, Alanina, Valina, Leucina, Metionina, Isoleucina, Prolina |
|
|
Como es la composición de los aminoácidos con grupo R alifático no polar? |
Sus R solo tienen C y H, excepto la metionina que contiene S (pero mantiene su apolaridad) |
|
|
Cuáles son los aminoácidos con grupo R aromático no polar? |
La fenilalanina, tirosina y triptófano |
|
|
Cuáles son los aminoácidos con Grupo R polares sin carga? |
Los que contienen átomos electronegativos en sus R, como la cistina, la serina, la treonina, la asparagina y la glutamina |
|
|
De qué depende la forma tridimensional de una proteína? |
De sus aminoácidos |
|
|
Cuáles son los aminoácidos con grupos R polares con carga negativa? |
Aspartato y Glutamato |
|
|
Cuáles son los aminoácidos con grupos R polares con carga positiva? |
Lisina, Arginina e Histidina |
|
|
Como se unen aminoácidos? |
A través de enlaces peptídicos |
|
|
Que compone un enlace peptídico? |
Entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amino (-NH2/3) del segundo aminoácido |
|
|
Cuál es la característica física del enlace peptídico? |
Muy estable y muy rígido, toma mucha energía para romperlo, su rigidez no permite giro de sus subproductos elementos |
|
|
Qué son péptidos? |
Moléculas formadas por amác unidos por enlaces péptidicos |
|
|
Cómo se pueden clasificar los péptidos? |
Según su peso molecular (n*amác<100, peso Mol>5000Dal -> proteínas) y según su cantidad de aminoácidos (entre 2 a 100 son péptidos, más de 100 es proteína) |
|
|
Qué es un residuo de aminoácidos? |
“Lo que quedó” del aminoácido tras formar el enlace |
|
|
Cuál es la diferencia entre oligopéptidos y polipéptidos? |
La cantidad de residuos de amác, oligo: pocos, poli: muchos |
|
|
Que tienen en su R los aminoácidos polares con carga negativa? |
Un grupo carboxilo |
|
|
Cuál es la unidad estructural de las proteínas? |
Los aminoácidos |
|
|
Cuál es la relación ácido-base con los aminoácidos polares de cargas positiva y negativa? |
Los con carga negativa son ácidos, los positivos bases |
|
|
Qué se encuentra en los aminoácidos polares con carga positiva? |
Un grupo sulfidrilo capaz de formar enlaces disulfuro |
|
|
Cuáles son tres ejemplos de aminoácidos no estándares? |
para la coagulación, el glutamato pasa a y-carboxiglutamato (agrega un COO-), la miosina se vuelve 6-N-Metilisina (al agregar un CH3) y en el colágeno la 4-hidroxipolina se vuelve 5-hidroxilisina (+ un OH) |
|
|
Qué es un pentapéptido? |
Un ejemplo de oligopéptido con 5 péptidos, como el seril-glicil-tirosil-alanil-leucina |
|
|
Como se ve químicamente el enlace peptídico? |
H | C — N || O |
|
|
Cuál carbono es el del N-terminal? |

Todos los aminoácidos se leen de izquia derecha, por ende siempre será el primer carbono |
|
|
Cuáles son 5 tipos de mecanismos de señalización funcionales por péptidos? |
La oxitocina (9 residuos), Bradquimina (9 residuos), Insulina (2 cadenas polipéptidicas, una de 30 residuos y la otra de 21), el factor liberador de tirotropina (3 residuos) y el Glucagón (20 residuos) |
|
|
Cuál es el tamaño promedio de las proteínas? (en residuos) |
En promedio unos 2000 residuos, sin embargo hay una gran variedad, como el citocromo c con 104 vs el titin con 27000 residuos |
|
|
Cuál es la estructura de gran parte de las proteínas? |
Formadas por más de una cadena polipeptídica que interactuan de forma no covalente o covalente, como por ejemplo, con puentes disulfuro |
|
|
Qué son las “subunidades”? |
Cadenas polipeptídicas |
|
|
Cuáles son cuatro ejemplos de aminoácidos no estándares? |
para la coagulación, el glutamato pasa a y-carboxiglutamato (agrega un COO-), la miosina se vuelve 6-N-Metilisina (al agregar un CH3) y en el colágeno la 4-hidroxipolina y la 5-hidroxilisina se crean (ambas al + un OH). La selenocistina se sintetiza antes de ser incorporado a las proteínas (+HSe) |
|
|
Qué y cómo ocurre cuando las cadenas de una proteína se hidrolizan? |
Estas se rompen, es decir se desnaturalizan, ocurre a través de pHs muy altos o temperaturas muy altas |
|
|
Composición de las subunidades de la hemoglobina |
Tiene 4 subunidades, dos de ellas son alfa, dos son beta, lo cual la hace un heterotetrámero |
|
|
Como ocurren los puentes disulfuro? |
A través de la oxidación del grupo sulfidrilo de dos moléculas de cisteína SH —> S |
|
|
Cuáles son 5 tipos de mecanismos de señalización funcionales por péptidos? |
La oxitocina (9 residuos), Bradquimina (9 residuos), Insulina (2 cadenas polipéptidicas, una de 30 residuos y la otra de 21), el factor liberador de tirotropina (3 residuos) y el Glucagón (29 residuos) |
|
|
Para qué son importantes los grupos prostéticos? |
Para la función biológica de la proteína |
|
|
Cuáles son 3 tipos de proteínas conjugadas y cuál es un ejemplo de uno de ellos |
Las lipoproteínas, las glicoproteínas y las metaloproteínas, como la hemoglobina, que tiene un átomo de hierro (en un anillo en el centro) como su grupo prostético, también llamada una proteína del grupo heme |
|
|
Cuáles son los niveles estructurales de las proteínas? |
Primario, secundario, terciario y cuaternario |
|
|
En qué consiste la estructura primaria de una proteína? |
En los residuos de aminoácidos |
|
|
En qué consiste la estructura secundaria de una proteína? |
Es el primer nivel estructural tridimensional, el más común es el alfa helix. Ocurre cuando los aminoácidos en la secuencia interactúan a través de enlaces de hidrógeno (puentes) |
|
|
En qué consiste la estructura terciaria de una proteína? |
En la cadena de polipéptidos. Es un plegamiento tridimensional de la proteína debido a las interacciones entre sus cadenas laterales , ciertas atracciones entre las hélices alfa o las láminas beta. Los “dominios” se forman aquí |
|
|
Cuál es el órden en trans___ de las proteínas? |
Transcripción -> mRNA -> Traducción -> Proteína |
|
|
Cuál es la estructura cuaternaria de una proteína? |
Son las subunidades ensambladas. La asociación de dos o más estructuras terciarias gracias a las chaperonas |
|
|
Que estructura determina la estructura tridimensional de una proteína? |
Su secuencia primaria de aminoácidos |
|
|
De qué depende la función de una proteína? |
De su estructura |
|
|
Qué fuerzas estabilizan la mayoría de las estructuras terciarias? |
No covalentes |
|
|
A qué se le llama conformación? |
Al arreglo espacial de átomos |
|
|
Qué es la conformación nativa? |
El estado de mayor estabilidad de una proteína en su entorno fisiológico ideal. Depende de las interacciones hidrofóbicas y electroestáticas, los puentes de hidrógeno y los de disulfuro |
|
|
Hacia dónde se orientan los residuos de aminoácidos hidrofóbicos/apolares? |
Hacia el interior/el centro de la proteína, lejos del agua |
|
|
Qué estabiliza las hélice alfa? |
Los puentes de hidrógeno |
|
|
En qué consiste la conformación Beta? |
En un tipo de estructura secundaria donde el esqueleto (conformación local de una parte del polipeptido) toma forma de zig zag formando plisados. Sólo grupos R pequeños pueden formar estas. |
|
|
Cuáles son las clasificaciones según forma de las proteínas? |
Las fibrosas, abundan en estructuras que dan soporte, forma y protección externa (ej colágeno: 35% glicina, 11% alanina, 21% prolina e hidroxipolina) y las globulares, que consisten en la mayoría de las enzimas y proteínas reguladoras del metabolismo |
|
|
Qué le da identidad al aminoácido? |
Su cadena lateral |
|
|
Cómo ayudan las chaperonas/chaperoninas en la estructura proteíca? |
Algunas proteínas pueden adquirir su configuración terciaria gracias a la ayuda en plegar a medida que se sintetizan que proveen |
|
|
Cuál es un ejemplo de defecto en el plegamiento de proteínas? |
Priones/la proteína prion (28000Dal), en bovinos se llama “vacas locas” y en humanos “Creutzfeldt-Jakob”, provoca encefalopatías enpongiformes que suelen ser fatales |
|
|
Qué es un multímero y un olígomero? |
Un multímero es una proteína con 2 hasta 100 subunidades (una proteína con estructura cuaternaria) se llaman olígomeros cuando tiene pocas subunidades |
|
|
En qué consiste la pérdida de conformación de la hemoglobina? |
Ocurre en la anemia falciforme donde el glóbulo rojo se vuelve puntiagudo y alargado, taponeando capilares y rompiendolos, creando hemorragias. Ocurre por la mutación de la subunidad beta donde un residuo de glutamato (polar) se cambia por un aminoácido apolar, lo cual altera la estructura terciaria (es decir, la forma en que las beta hablan entre sí) formando fibrillas que llenan y cambian la forma del glóbulo |
|
|
Cuáles son las clasificaciones según forma de las proteínas? |
Las fibrosas, son insolubles en agua y abundan en estructuras que dan soporte, forma y protección externa (ej colágeno: 35% glicina, 11% alanina, 21% prolina e hidroxipolina) y las globulares, que consisten en la mayoría de las enzimas y proteínas reguladoras del metabolismo |
|
|
Qué grupos funcionales componen a un aminoácido? |
Un grupo amino y un grupo carboxilo unidos al mismo carbono |
|
|
Cuáles son los aminoácidos con grupo R alifático no polar? |
Glicina, Alanina, Valina, Leucina, Metionina, Isoleucina, Prolina |
|
|
Como es la composición de los aminoácidos con grupo R alifático no polar? |
Sus R solo tienen C y H, excepto la metionina que contiene S (pero mantiene su apolaridad) |
|
|
Cuáles son los aminoácidos con grupo R aromático no polar? |
La fenilalanina, tirosina y triptófano |
|
|
Cuáles son los aminoácidos con Grupo R polares sin carga? |
Los que contienen átomos electronegativos en sus R, como la cistina, la serina, la treonina, la asparagina y la glutamina |
|
|
¿A qué clasificación pertenecen los aminoácidos que poseen más de un grupo amino en su estructura, como la histidina, la arginina o la lisina? |
Aminoácidos polares básicos/carga positiva |
|
|
Cuando se conocen los aminoácidos que componen una proteína y el orden en que estan ensamblados, se dice que conocemos: |
Su estructura primaria |
|
|
¿Qué información obtenemos al conocer la secuencia de un péptido? |
Qué aminoácidos lo componen y en qué orden |
|
|
¿A qué se refiere el concepto de "estructura secundaria de una proteína"? |
Es la disposición espacial de un polipéptido al plegarse sobre sí misma adoptando una forma espacial y características determinadas. |
|
|
¿Qué le ocurre a una proteína cuando se desnaturaliza? |
Pierde todas las estructuras de orden superior (secundaria, terciaria y cuaternaria). |
|
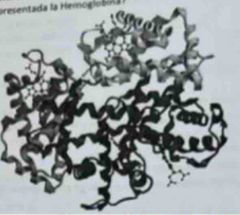
La figura corresponde a la estructura de la hemoglobina, proteína responsable del transporte de oxígeno ¿Con qué nivel estructural se encuentra representada la Hemoglobina? |
Estructura cuaternaria |

