![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
3 Cards in this Set
- Front
- Back
|
PRINCIPIO DE LE CHANTELIER |
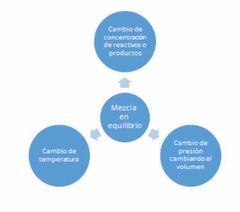
A finales del siglo XIX, el químico francés Henry le Châtelier (1850- 1936) postuló que cuando en un sistema en equilibrio se modifica cualquiera de los factores mencionados, se afecta la velocidad de la reacción y el punto de equilibrio se desplaza en la dirección que tienda a contrarrestar el efecto primario de dicha alteración.
|
|
|
Concentración |
Cuando la concentración de una de las sustancias en un sistema en equilibrio se cambia, el equilibrio varía de tal forma que pueda compensar este cambio.
Por ejemplo, si se aumenta la concentración de uno de los reaccionantes, el equilibrio se desplaza hacia la derecha o hacia el lado de los productos.
Si se agrega más reactivos (como agregar agua en el lado izquierdo del tubo) la reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio. Si se remueven los productos (como quitar agua del lado derecho del tubo) La reacción se desplazará hacia la derecha hasta que se restablezca el equilibrio. |
|
|
Temperatura. |
La variación de equilibrio causada por un cambio de temperatura dependerá de si la reacción tal como esta escrita es exotérmica, o endotérmica.
Reacciones Exotérmicas Si la reacción es exotérmica se puede considerar al calor como uno de los productos, por lo que al aumentar la temperatura el equilibrio se desplaza hacia la izquierda.
A + B AB + calor
Si se disminuye la temperatura, el equilibrio se desplazará hacia la derecha.
Reacciones Endotérmicas Si la reacción es endotérmica, el calor se considera como un reactivo.
A + B + calor AB
Por lo tanto, si se aumenta la temperatura se favorece un desplazamiento del equilibrio hacia la derecha y si se disminuye, hacia la izquierda. |

