![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
62 Cards in this Set
- Front
- Back
|
oladdad atom har 35 neutroner och 29 protoner
ange a)namn b)atomnummer c)masstal |
a) koppar Cu
b)antalet protoner och elektroner(inte sammanlagt) se koppar med antommr 29. c)summan av antalet protoner och neutroner |
|
|
ge exempel på
a)homogenblandning b)Jonförening c)fission d)energienhet e)kovalentbindning f)halogener g)ozon h)CFC gaser i)dipol j)molekyl med trippelbinding |
a)luft
b)koksalt c)Kärnklyvning d)Joule e)elektronparbildning f)klor,brom.jod g)växthusgas h)freoner i)vatten j)N2 |
|
|
Vilken bindning bryts när dessa ämne i fast form smälter?
a)Jod b)Is c)Väteklorid d)natriumklorid |
a) Jod från grupp 17 halogenerna, har samma egenskaper som alla halogener i grupp 17. dem har 7 valenselektroner och bildar gärna molekyler genom elektronparbildning dvs. kovalentbindning. Molekylerna är opolära dvs har en symmetrisk laddningsfördelning över hela molekylen. opolära molekyler har "Wan der Waals bindning" . svar Wan der waals bindning för JOD.
b) IS - : Vätebindning bryts, det är stark bindning som uppstår mellan Dipoler där den positiva delen utgörs av en väteatom. c) Väteklorid (s) : Dipol-Dipol bindningar bryts d) Natriumklorid (s) : Jonbindning , Det är jonförening mellan positiva och negativa joner. |
|
|
Skriv formlerna för de jonföreningar som bildas när följande joner kombineras till salter:
a) Aluminiumjoner och kloridjoner b) Magnesiumjoner och jodidjoner c) Kalciumjoner och nitridjoner |
a) Aluminiumjoner och kloridjoner :
Al3+ + Cl- =>AlCl3 (s) b) Magnesiumjoner och jodidjoner : Mg2+ + I- => MgI2 c)Kalciumjoner och nitridjoner : Ca2+ + N3- => Ca3N2 |
|
|
Vilka av följande föreningar är dipoler? Motivera dina val med ord och/eller förklarande figurer.
H2O HCl CH3Cl NaCl CO2 CO |
Dipol är en molekyl där molekylen eller atomgruppen har en positiv eller negativ ände dvs dem är polära och det går att mäta med hjälp av elektronegativitetsskillnaden.
Molekylens geometri spelar också en roll i hurvida det är en dipol eller inte. DIPOL ---- TVå poler! H2O : Är ett bra exempel på en Dipol, eftersom syre är mycket mer elektronegativt än väte blir O-H bindningarna polära.Molekylens gemotri är vinklad och detta innebär att centrum för den positiva och negativa laddningen kommer inte ligga på samma ställa, genom detta kan man konstantera att molekylen är en Dipol. HCI : HCl är också en dipol då elektronegativiteten är i motsatt håll från varandra detta kan ses tydligt i strukturformeln för HCl : CH3CL : klormetan är också en dipol vilket också kan oberveras utifrån dess strukturformel: NaCI är INGEN dipol, det är en jonförening! CO2 är INGEN DIPOL pga struktur CO är en dipol,syre atomen är negativt laddad och kol atomen är positivt laddad. olik ladd |
|
|
Skriv formel för fullständig förbränning av hexan (C6H14).
|
REAKTIONEN I ORD : Hexan + Syrgas -> Koldioxid + Vatten
2C2H14 + 19O2 ->12CO2 + 14H2O |
|
|
Beräkna med korrekt enhet:
a) Formelmassan för NaBr. b) Molmassan för Al2(SO4)3. Visa dina beräkningar! |
a) Formelmassa
Formelmassa för ett ämne är summan av atommassorna i ämnetsformel. NaBr : Na(atommassa) + Br(atommassa) = 22,99 + 79,90 =102,89 u b) Molmassa har beteckningen M och enheten 1g/mol Al2(SO4)3 = 26,98 * 2 + (32,06 + 16,00 * 4 ) * 3 = 342,14 g/mol |
|
|
a) Vilken typ av bindning uppkommer när alkoholer löses i vatten? Motivera ditt svar.
b) Vilken av alkoholerna 1,4-butandiol eller 1-butanol kan man förvänta sig är mest löslig i vatten? Motivera ditt svar. c) Vilket ämne bildas vid oxidation av 1-butanol? Ange namn och strukturformel. |
?????
a) vätebinding b)eftersom 1,4-butandiol har två OH-grupper blir det också mer vätebindningar, därför är den löslig i vatten i alla proportioner, c)butanal och butansyra |
|
|
Hur mycket kol måste man tillsätta för att tillverka rent järn ur 20,0 ton järnoxid (Fe2O3)? Det bildas också kolmonoxid. Redovisa dina beräkningar.
|
Balanserad reaktionsformel med 3 kolmonoxid molekyler och 2 järnmolekyler osm endprodukt.
Fe2O3 + 3C ->2Fe + 3CO Beräkning; Givet :massa (Fe2O3) = 20,0 ton 20,0 ton = 20 * 10^6 g sökes :massa (g) av kol massan kan beräknas genom formeln : m = M * n Jag tar fram Molmassan för Järnoxid Fe2O3 (55,85 * 2) + (16,00 * 3 ) = 159,7 g/mol n= m/M n = 20,0 * 10^6 g / 159,7 g/mol n= 125235 mol Detta är substansmängden för Järnoxid Fe2O3, eftersom det går 3 gånger så många mer mol kol än järnoxid multipliceras mol för järnoxid med 3 och vi får fram substansmängden ( mol) för kol. n (kol) = 125235 * 3 = 375705 m (kol) = 375705 * 12,01 = 4512217,0 g Svar : 4,5 ton kol |
|
|
Förklara hur du skulle göra för att bereda 2,0 dm3 natriumhydroxidlösning med koncentrationen 0,25 mol/dm3. Redovisa dina beräkningar!
|
Natriumhydroxid = NaOH
Givet: v = 2,0 dm3 Sökes : Bestämd koncentration 0,25 mol/dm3 Beräkning : samband för koncentration c = n/V n = V * c n = 2,0 * 0,25 = 0,5 mol 0,5 mol NaOH kan användas för att förbereda an natriumhydroxid lösning med koncentrationen 0,25 mol/dm3. För att förbereda detta måsta vi veta hur mycket 0,5 mol NaOH väger samband gäller för NaOH massa = substansmängd * Molmassa Molmassa av NaOH = 40 g/mol m = 0,5 mol * 40 g/mol = 20 g Svar: För att att förbereda en NaOH lösning av volymen 2,0 dm3 med den bestämda koncentrationen = 0,25 mol/dm3 krävs 20 g NaOH. |
|
|
.) Beräkna pH i:
a) en lösning som har [H+]=0,100 mol/dm3. b) en natriumhydroxidlösning med koncentrationen 0,010 mol/dm3. Redovisa dina beräkningar. |
a) 0,100 mol/dm3
skrivs om som tio potens = 10-1 pH= -log (10-1) svar : pH = 1,0 b) NaOH lösning med c = 0,010 mol/dm3 natriumhydroxiden finns som fria joner. [OH-] = 0,010 mol/dm3 [OH] - = 10-2 mol/dm3 ->pOH = 2,0 pH = 14,0 - 2,0 PH = 12,0 |
|
|
) Du vill framställa metylpropanoat.
a) Vilka ämnen skall du utgå ifrån? b) Till vilken ämnesklass hör reaktionsprodukten? c) Skriv reaktionsformel med strukturformler. |
a) Metanol och propanolsyra
b) Det är en Ester. Ester är en en syra + en alkohol c) c) CH3OH + C2H5COOH ->C2H5COOCH3 + h20 (balansera C och se om rätt)??!! |
|
|
00 cm3 0,20 mol/dm3 svavelsyra skall neutraliseras genom tillsats av natriumhydroxid.
a) Skriv reaktionsformeln för neutralisationen. b) Beräkna massan natriumhydroxid som behövs. Redovisa dina beräkningar. |
a) I en neutralisations reaktions bildas det vattenmolekyler
Reaktionsformel : NaOH + HCI ->NaCI + H2O b) massan av NaOH förhållandet för massa gäller att : m = M * n Vi beräknas först hur många mol som behövs genom sambandet : n = c * v n = 0,100 * 0,20 = 0,02 Det krävs 0,020 mol NaOH Molmassan = 40 g/mol m= 40 * 0,02 = 0,8 g Svar : 0,8 gram Du har skrivit om saltsyra men frågan gäller svavelsyra, formeln blir H_2SO_4+2NaOH=>2Na^(+)+SO_4^(2-)+2H_2O , det går alltså åt två mol NaOH per mol svavelsyra, dvs 1,60 g!!!! SEEE |
|
|
.) Plasten PVC har en sammansättning som motsvarar formeln C2H3Cl. Då PVC förbränns i luft bildas koldioxid, vattenånga och väteklorid.
a) Ställ upp en balanserad reaktionsformel för förbränningen. b) Man förbränner 0,80 kg PVC. Vilken massa har den bildade vätekloriden? c) Vilken volym luft går åt vid förbränningen? Räkna med en molvolym på 25 dm3/mol. |
"Card blank"
|
|
|
egenskaper av
Grupper i ett periodisk system och perioder i ett periodisk system |
grupper = lika många valenselektroner,likartade kemiska och fysikaliska egenskaper bland huvudgrupperna. för varje steg vi tar neråt i en grupp tillkomer ett nytt skal och radien ökar.
period: periodernas numerering anger antalet skal. för varje steg höger i en period tillkommer en proton till kärnan. |
|
|
Ange huvudgrupper i det periodiska systemet
hur många är dessa |
Huvudgrupper
1-2 + 13 - 18 resten är övergångsmetaller. 1 = alkalimetaller 2 = alkaliskajordartsmetaller 13 = Borgruppen 14= kolgruppen 15=kvävegruppen 16=Syregruppen 17=halogener 18 = ädelgaser |
|
|
Beskriv "kort" egenskaper till Alkalimetallerna?
|
Alkalimetallerna är den först gruppen i det periodiska systemet.
- En valenselektron - Mest reaktiva gruppen - Finns inga av dessa element fritt i naturen - Reagerar med vatten under bildning av vätgas och kraftig värmeutveckling. - Ger karaktäristisk färg åt låga. - Lätta och mjuka metaller -ju längre ner man går i gruppen desto längre bort hamnar elektronen från kärnan och ju lättare är det för atomen att avge den därför har cesium mer reaktivitet än Rb till exempel. |
|
|
Beskriv "kort" egenskaper av Alkaliska jordartsmetallerna
|
- Vanliga i jordskorpan
- 2 valenselektroner - Sjunkande smält och kokpunkter neråt i gruppen - Reagerar med vatten och bildar vätgas och värmeutveckling |
|
|
Beskriv "kort" egenskaper av Borgruppen nr 13
|
- Består av bl.a Bor, Aluminium, Gallium
- 3 valenelektroner - |
|
|
Beksriv "kort" egenskaper av Halogenerna
|
- Grupp 17
- 7 valenselektroner - mycket reaktiva med metaller - icke metaller - Bildar lätt salter i reaktion med metaller - - |
|
|
Beskriv "kort" egenskap av grupp 18
|
- Ädelgaserna
- Fullt elektronskal - reagerar inte lätt med andra - enatomiga i naturen - finns här radioaktivaämnet radon Rn |
|
|
Vad är en Dipol och vad utmärker en dipol
ge exempel |
dipol = DI POL dvs. två olika poler
- ojämn laddningsfördelning i en molekyl. en molekyl med en positiv och en negativ ände. - dipol-dipol bindningar finns också mellan "dipolerna" - osymmetrisk struktur - vatten molekyl en dipol,väteklorid,kvävemonoxid - |
|
|
Exempel på vätebindningar + defintion
|
- vätebindning sker mellan atomer med högst elektronegativitet dvs. F (flour) O (syre) N(kväve) om dessa bind med väte bildas vätebindning. vätebinding sker i en molekylförening.
- intermolekylär bindning dvs. en bindning som verkar mellan molekyler.medan ex kovalent och jonbinding är bindningar mellan atomer. |
|
|
Wab der waals bindning
|
- binding mellan molekyler.
- sker inom en dipol dipol bindning då elektronerna rör sig i ett elektron moln kan det ske att att den ena molekylen varierar mellan att vara en tillfällig dipol och ej dipol då uppstår svaga bindningar mellan molekylerna det är wan der waals bindningen. molekylerna blir tillfälligt exiciterade och dras till varandra. |
|
|
Exempel på wan der waals bindningar
|
- ädelgaser kan ha w.w bindning
- O2, H2 -större molekyl storlek ger ökad W.W binding |
|
|
hur kan man med hjälp av elektronegativiteten ta reda på vilken sorts bindning som finns mellan atomerna.
|
- ju längre ifrån varandra atomerna befinner sig i elektronegativitet så är attraktionen större mellan atomerna.
- om skillnaden är tillräckligt stor så kommer atomerna dra elektroner från varandra och "Jonbindning" uppstår. - skillnad liten eller noll : jämn fördelning av elektroner kommer att ske och blir en opolär kovalent bindning. - om skilland i elektronegativitet är större än 2,0 mellan atomerna så blir det " Jonbindning" - elektronegativitet skillnad mindre än 1,7 = kovalent binding mellan atomerna - elektronegativitet = O --->bindningen är opolär kovalent. |
|
|
Nämn 3 intramolekylära bindningar
|
1.dipol-dipol binding : mellan polära molekyler
2. vätebindining: då väte binder antingen F,O,N 3. wan der waals binding : oplära molekyler |
|
|
vilka bindningstyper finns i grundämnena
- vilka 6 grundämnen har elektronparbildning i naturen ? |
1. metallbindning mellan metallerna
2.elektronparbildning/kovalentbinding : Cl2, O2, N2, F2, I2, Br2. kallas elektronparbindning eftersom det är en elektron som binder ihop atomerna likt ett "lim" |
|
|
Definera
Rena ämnen: Grundämnen Kemiska föreningar Blandningar: Homogena Hetrogena |
Grundämne : ett ämne som består av samma slags atomer.en aluminium bit
Kemiska förening: ett ämne som består av mer än en sorts atom.exempel vatten Homogen: exempel luft, beståndsdelarna är så väl blandade att det inte går att urskilja dessa.Läskedryck ett annat exempel. Hetrogen: exempelvis vatten och olja, dessa båda går att urskilja. |
|
|
vad delas grundämnen i ? 3 grupper
|
Metaller :
- metallglans - leder elektrisk ström - leder värme - kan smidas Halv metaller: - har några metallegenskaper Icke metaller - exempel grupp 18 - gaser, har inte egenskaper som metaller |
|
|
Kemiska föreningar indelas i ? 2 grupper
|
Jonföreningar : uppbyggd av elektrisk laddade partliklar, attraktionskraft mellan joner
Molekylföreningar : hålls samman av elektronparbindingar/kovalentabindningar |
|
|
Ge 3 exempel på molekyler med vätebindning?
|
antal vätebindningar:
- Vatten 2 - Ammoniak 1 - Väteflourid 1 |
|
|
Metallbindning
- definition |
- ett elektronmoln där fria elektroner rör sig
- kan böjas utan att gå sönder till skillnad mot jonbindning där en förändring skulle få elektronerna att repallera mot varandra. - ju fler fria elektroner i elektronmolnet desto starkare blir bindingen - exempel magnesium 2e- har starkare binding än natrium 1 e- -metall + metall |
|
|
vilka kemiska begrepp beskrivs
a) atomer av samma grundämne med olika antal neutroner i atomkärnan? b) en atoms förmåga att attrahera elektroner c) Ett ömne som när det löses i vatten bildar hydroxidjoner -OH d)slutprodukten då en atom avgivit eller upptagit en elektron e)bindingen mellan två atomer i ett ämne som har differen si elektronegativitet som är 1,0. |
a) Isotop
b)Elektronegativitet c)Bas d)Jon e)Polärkovalent binding |
|
|
Ange om följande ämne är element,föreningar,blandningar
a)guld b)bakpulver som består av natriumvätekarbonat c)inehållet i ett glas vin d)mässing e)koksalt f)jord |
a) element
b)förening NaHCO3 c)Blandning d)Blandning fast lösning e)förening f)blandning |
|
|
vad är spontana reaktioner?
nämn 3 saker man ska tänka på för att ta reda på om en reaktion är spontan eller inte? |
-reaktioner som sker utan att energi tillförs från något håll, spontana reaktioner är oftast exoterma dvs, dem avger energi och värme.
- normalpotentialerna dvs. ämnet som oxideras måste befinna sig i reducerad form. - spontana reaktioner starta av sig själv eller kan hålla igång efter energitillförseln. - spänningsserien eftersom ädlare metaller drar till sig elektroner mer än oädla metaller. |
|
|
skillnaden mellan bindningsentalpi och bindningsenergi?
skillnad hur hänger dem ihop |
Bindningsentalpi = är delta H dvs. energi förändringen av 1 mol från ett grundämne.det kan vara både positivt eller negativt . negativt delta H innebär en exoterm reaktion dvs. energi frigörs till omgivningen. medan endoterm innebär ett upptag av energi + delta H.
bindingsentalpi är också mått på ett ämnes stabilitet.låg bildningsentalpi innbär att stabils ämne. bindinsenergi : är den mängd energi som krävs för att bryta en bindning. skillnad mellan dessa: bindingsenergi kan aldrig vara negativt eftersom det alltid krävs en viss energi för att bryta en bindning. begreppen hänger ihop eftersom ämnen med mycket låg bindingsentalpi kräver mycket bindningsenergi för att bildas.och krävs lika mycket energi för att få dessa ämnen att brytas också och det ger dessa ämnen dess stabilitet. ökad stabilitetetn ger ämnet ett hög bildningsenergi. - bindningsentalpin kan beräknas om man känner till bindningsenergi för reaktanterna och produkterna. |
|
|
ge exempel på en exoterm och en endoterm reaktion
|
- exoterm = energi avges till omgiviningen -delta H
ex. "förbränning" av metan metan + syras = koldioxid + vatten endoterm = energi tas upp + delta H ex) "sönderdelning "av kalciumkarbonat : kalciumkarbonat -->kalciumoxid + koldioxid |
|
|
hur beräknas entalpi
|
deltaH= H produkter - H reaktanter
positivt = endoterm reaktion negativt = exoterm reaktion praktiskt kan detta i labboration med reaktioner i vatten om vattnet blir varmt = exoterm om kallt = endoterm. |
|
|
hur omvandlas celcius till kelvin ?
-finns en befintlig formel och en konstant |
T(kelvin) = T(celcius) + 275,15
tvärtom celsius = kelvin - 275,15 |
|
|
Entalpi övning
- Exoterm reaktion fråga: hur mycket värme frigörs när 24 g kol förbränns fullständigt så att det bildas koldioxid? |
svar: C(s) + O2(g) -->Co2(g)
deltaH= -394 kJ 1 mol C <--> 394 kJ energi m(C) = 24 g M(c) = 12 g/mol n (C) = 24g/mol/ 12g * mol-1 = 2,0 mol Energi = 2,0 * 394kJ = 288 kJ svar; 790 kJ värme frigörs detta är en exoterm reaktion. |
|
|
Entalpi övning
- Endoterm reaktion fråga: hur mycket energi upptas när det bildas 1,0 mol kväveoxid ur kväve och syre? |
N2(g) + O2(g) ---> 2 NO8(g)
deltaH = +180kJ 2 mol NO <--> 180 kJ 1 mol NO --> 90 kJ svar: 90 kJ upptas när 1 mol NO bildas. |
|
|
Oxidationstalen?
- vad är oxidationstal - regler 6 viktiga |
- oxidationstal är ett tal man ger varje atom slag i ett ämne för att lättare kunna avgöra vilka som reducerats och vilka som oxiderat.
- skrivs med romerska siffror med ett + eller - tecken framför. - kan vara negativt vilket innebär överskot av elektroner. - kan vara positivt vilket innebär underskott av elektroner "avger" - oxderas ökning av OT .....Reduceras minskaning av OT. - LEO says GER = leaving electrons oxidation Gaining electrons Reduktion. - oxidationstalet kan vara noll - skrivs ovanför atomslaget. 6 viktiga regler för oxidationstal 1. atomer i ett grundämne har oxidationstalet noll. EX) Fe , Na 2.väte i sina föreningar har oxidationstalet +I. Ex)HCI H = +I 3. syre har i sina föreningar OT -II (undantag Ex) H2O ...O = -II 4.i en molekyl är summan ingående atomernas oxidationstal noll. Ex) H2O.....H = -I , O = +II 5.i en atomjon är oxidationstalet lika med jonladdningen Ex)Na+ --> +I 6.i sammansatta joner är summan av de ingående atomernas oxidationstal lika med jonladdningen. No3- ----> N=+IV , O=-II |
|
|
a) Förklara den galvaniska cellen för reaktionen:
Mg (s) + Cu2+(aq) ---> Mg2+ + Cu(s) + energi förklara i ord |
En magnesiumstav sänks ner i en magnesiumsulfatlösning och en kopparstav sänks ner i en kopparsulfatlösning. Lösningarna separeras av ett glasmembran vilket hindrar kopparjoner från att direkt reagera med magnesiumstaven.
Genom att använda en yttre ledning så kan vi utnyttja den ström av elektroner som uppstår till att utföra ett arbete. Men först måste vi sluta kretsen. Nu oxideras magnesiumstaven till magnesiumjoner. Här produceras elektroner och eftersom de är negativt laddade är detta den negativa polen. När elektronerna når fram till kopparstaven tas de emot av kopparjoner i lösningen som reduceras till metalliskt koppar. I elektrolytlösningen vandrar sulfatjonerna mot den negativa polen för att neutralisera effekten av magnesiumjonerna. De positiva jonerna vandrar följaktligen mot pluspolen. Reaktionen utvecklar också värme Vi kan teckna den galvaniska cellens reaktioner i ett cellschema. Dubbelstrecket anger gränsen mellan de två lösningarna. -Mg(s) | Mg 2+ | | Cu 2 + | Cu(s)+ På var sin sida skriver vi upp de två delreaktionerna - minuspolen till vänster och pluspolen till höger. Här visas elektrodreaktionerna och cellreaktionen. o (-)-pol, ox.: Mg(s) → Mg2+(aq) + 2e- o (+)-pol, red.: Cu2+(aq) + 2e- → Cu(s) o Cellreaktion: Mg(s) + Cu2+(aq) → Mg2+(aq) + Cu(s) |
|
|
vad är galvanisk cell?
|
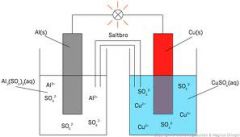
En galvanisk cell är alltså uppbyggd av två halvceller som är ihopkopplade med varandra via en saltbro
Istället för att minuspolen består av Zn som i figuren nedan har vår galvaniska cell istället en magnesiumelektrod som minuspol. Både Zn- och Mg- metallerna är oädlare än Cu och blir därför bra reduktionsmedel för Cu (pluspolen). |
|
|
Beräkning av emk
|
E = +0,34V – (-2,37V) = 2,71V
|
|
|
vad är korrosion
- defenition och phenomen 1. kemisk angrepp av gaser 2.fuktighet |
Många metaller kan korrodera i luft under inverkan av syre, fuktighet samt fasta och gasformiga föroreningar. Då bildas metalloxid. Korrosionen kan snart upphöra om oxider är:
- sammanhängande - inte innehåller porer - har god vidhäftning - är beständig mot luft och fuktighet Några metaller t.ex. aluminium, krom, nickel och kobolt täcks med sådana skyddande oxidskikt. De är tunna – tunnare än 0,001 mm. Om oxiden däremot är porös eller har dålig vidhäftningsförmåga, fortsätter förstöringen av metallen. Järn och magnesium är exempel på metaller som inte är beständiga i luft. 2.Järn rostar snabbt när det ligger ute i det fria. Det rostar också när det ligger i ouppvärmda lokaler. Förvaras järn däremot i varma lokaler rostar det knappast alls. Genom försök kan man visa att järnets rostning hänger samman med luftens relativa fuktighet. Är den lägre än 60% (50% om luften är saltmättad som här i närheten av havet) sker ingen rostning!! I Sverige varierar luftfuktigheten tyvärr mellan 60% och 85%, en utmärkt miljö för järn att rosta i. Om syrehalten i vatten minskar, minskar också korrosionen. Detta är anledningen till att rörsystemet i en centralvärmeanläggning endast långsamt angripes av rost. |
|
|
elektrokemisk korrosion
|
Då två metaller står i ledande förbindelse med varandra och samtidigt utsätts för fukt, bildas en korrosionscell. Om t.ex järn och koppar står i förbindelse med varandra genom en elektrolyt t.ex saltvatten blir järn negativ pol och koppar positiv pol, eftersom järn är oädlare än koppar.
Vid den negativa polen sker alltid oxidation, vid den positiva en reduktion Negativ pol: Fe –> Fe2+ + 2e- Vid den positiva polen kan man tänka sig ett par olika reaktioner. Det viktiga är att den negativa polen, som också kallas upplösningspolen, löses upp !! Ett klassiskt exempel på denna korrosioncell är kopparplåt, ,fastspikad med järnspik på båtskrov, med havsvattnet som elektrolyt. Järnspikarna kommer att lösas upp!Vad händer då om vi spikar fast aluminiumplåt med järnspik? Jo, man får frätning i aluminiumplåten. Använder man galvaniserad (förzinkad) spik, blir anfrätningen mindre. Om aluminium kombineras med koppar går korrosionen snabbare än med järn. En aluminiumskorsten på ett koppartak fräts snabbt sönder. |
|
|
Järnets rostning
|
Rent järn har ingen praktisk användning. Det är först när järnets legerats med kol och med andra ämnen , som man får en användbar produkt. I stål ingår alltid andra ämnen än järn. I små mikroområden finns därför ämnen med olika galvaniska egenskaper. Man kan hitta positiva och negativa poler. Grafitkorn bildar t.ex positiva poler. Om stålet är i kontakt med vatten uppstår galvaniska celler på stålytan.
Negativ pol: Fe –> Fe2+ + 2e- Positiv pol: O2 + 2 H2O + 4e- –> 4 OH- Genom fortsatta reaktioner bildas rost av järn(II)jonerna. Rost är en blandning av järnoxid och järnhydroxid. Anges ofta som FeO(OH). |
|
|
1,Elektrokemiskt korrosionsskydd
2.Ytbehandling...4 alternativ |
Ett sätt att skydda större järnföremål mot korrosion är att koppla ihopa föremåle med en metall vars normalpotential är lägre än järnets. Vanligtvis används zink eller magnesium, som då blir negativ pol och oxideras. En metall som oxideras, löses upp, brukar kallas offeranod. Järnet oxideras då inte. Det skyddas mot korrosion av elektronerna från offeranoden.
Offeranoder används för att korrosionsskydda rörledningar och kablar, fartygsskrov, kajanläggningar, oljeplattformar och varmvattenstankar av stål. 2.Ytbehandling skyddar metallerna för angrepp av luft och fuktighet. Några av de vanligaste metoderna för ytbehandling är: 1) Elektrolytisk utfällning 2) Doppmetallisering 3) Målning 4) Beläggning med oljeprodukter och plaster |
|
|
I sur lösning kan Fe2+-joner oxideras till Fe3+-joner i närvaro av permanganatjoner (MnO4).???
Det bildas också manganjoner (Mn2+). Skriv en balanserad reaktionsformel. Redogör för samtliga steg i hur du kommer fram till formeln! - steg för steg |
Jag börjar med att skriva formlerna för reaktanter och prudukter. Fe2+,MnO4-, Fe3+ och Mn2+ är givna i uppgiften och skrivs därför in. Det står också att reaktionen sker i en sur lösning, därav finns även H+ med i formeln. Då kan man se att det på högersidan borde finnas väte och syre, eftersom detta finns med på vänstra sidan. Alltså bildas även vatten.
Fe2+ + MnO4- + H+ --→ Fe3+ + Mn2+ + H2O Nästa steg är att skriva ut oxidationstalen för både reaktanter och produkter. Oxidationstalet för Fe2+-jonerna är +II eftersom laddning är tvåvärt positiv hos den. Permanganatjonen har en negativ laddning och därför ska summan av dess ingående atomers oxidationstal också vara -1. Det är känt att syre har oxidationstalet -II och det finns fyra syreatomer, vilket ger -8 i laddning. Därför manganatomen oxidationstalet +VII. Att väte har oxidationstalet +I är känt och det är även givet eftersom vätejonens laddning är just +1. Fe3+-jonen har laddningen +3 och därför blir oxidationstalet +III eftersom det alltid ska stämma överens med jonladdningen. Detsamma gäller för manfanjonen, dess jonladdning är +2 och därför blir oxidationstalet +II. Som jag nämnde tidigare är oxidationstalen för väte och syre kända och summan av dem i vattenmolekylen blir 0, precis som det ska. Detta beror på att vattenmolekylen är en oladdad partikel, en molekylförening. +II +VII -II +I +III +II +I -II Fe2+ + MnO4- + H+ --→ Fe3+ + Mn2+ + H2O Därefter beräknas antalet steg som var och en av de reagerande atomerna/jonerna. Järnjonen oxideras, dess oxidationstal ökar med ett steg. Manganatomen reduceras, dess oxidationstal sjunker fem steg. Eftersom manganjonen alltså har tagit upp fem elektroner måste det finnas fem järnjoner som avger en elektron var. Då blir det totala antalet steg för minskinen och ökningen detsamma. Därför behövs det alltså fem formelenheter järnjoner, koefficienten 5 skrivs framför järnjonerna. +II +VII -II +I +III +II +I -II 5 Fe2+ + MnO4- + H+ --→ 5 Fe3+ + Mn2+ + H2O Nästa steg är att balansera summan av laddningarn så att de är lika på båda sidorna. Då behövs inte oxidationstalen längre. 5 Fe2+ + MnO4- + H+ --→ 5 Fe3+ + Mn2+ + H2O På höger sida finns 11 plusladdningar och en minusladdning, summan är alltså +10. På den västra sidan finns 17 plusladdningar, summan är alltså +17. Genom att justera antalet vätejoner kan denna olikhet jämnas ut. 5 Fe2+ + MnO4- + 8 H+ --→ 5 Fe3+ + Mn2+ + H2O Nu är laddningarn på båda sidor +17. Det som nu ska kontrolleras är att det finns lika många syre- och väteatomer på varje sida om pilen. Det finns fyra syreatomer och åtta väteatomer på väster sida och då måste en koefficient skrivas framför vattenmolekylen för att balansera detta. 5 Fe2+ + MnO4- + 8 H+ --→ 5 Fe3+ + Mn2+ + 4 H2O Nu kontrollräknas atomerna av varje ämne på varje sida. Det finns 5 järn-, 1 mangan-, 4 syre- och 8 väteatomer på varje sida och formeln är nu balanserad. 5 Fe2+ + MnO4- + 8 H+ → 5 Fe3+ + Mn2+ + H2O |
|
|
Beskriv en analysmetod och när du skulle kunna tillämpa den! Förklara även varför just den analysmetoden är mest lämplig!
1. vad är spektroskopiska analysmetoder. förklara kortfattat emission, absorption |
Spektroskopiska analysmetoder
Bakgrund • Energin i atomer och molekyler kan bara anta vissa väl bestämda nivåer. Energin är kvantiserad. Bilden till höger visar energinivåer i väteatomen. • Elektromagnetisk strålning består av partiklar, små vågpaket, som kallas fotoner. • Fotonen har en viss energi, som ges av ekvationen där E är energin, h är Plancks konstant och är fotonens frekvens. I synligt ljus beror ljuset färg på dess frekvens. • Kemiska ämnen ger spektra när de växelverkar med elektromagnetisk strålning • Många kemiska analysmetoder bygger på att ämnena ger spektra när de utsätts för elektromagnetisk strålning. Absorption Om en atom eller molekyl träffas av en foton kan atomen eller molekylen ta upp energin som finns i fotonen. Fotonen absorberas och försvinner. Detta inträffar dock bara om energin i fotonen precis motsvarar skillnaden mellan två energinivåer i atomen/molekylen. Annars passerar fotonen opåverkad. Strålningen går då rakt genom materian. Emission En atom/molekyl som tagit upp energi och hamnat i en högre energinivå är exciterad. Den strävar efter att falla tillbaka till lägsta möjliga energinivå. Ett sätt den kan göra detta är genom att avge överskottsenergin i form av en foton. Atomen/molekylen avger elektromagnetisk strålning, t.ex. synligt ljus. Fotonen får då en energi som precis motsvarar skillnaden mellan energinivåerna i atomen/molekylen. Detta är en process som kallas emission. Om exciteringen beror på absorption av strålning kallas processen fluorescens. Ett spektrum kan tala om vilket ämne man har i ett prov. Energinivåerna i atomer och molekyler är unika för ett visst ämne. Ämnet kommer bara att absorbera strålning där fotonerna har precis de energier som motsvarar skillnaden mellan olika energinivåer. Om man undersöker vilka våglängder som försvinner, när man belyser ämnet med strålning av olika våglängd, får man ett spektrum. Detta kan t.ex. användas för att ta reda på vilket ämne det är. |
|
|
beskriv analysmetoden titrering
|
Beskrivning av analysmetoden titrering:
Titrering är en analysmetod som utgår från kända reaktioner mellan två ämnen där det ena ämnets koncentration är känd och det andra ämnets koncentration är okänd. Det ämne vars koncentration är okänd är den s.k. provlösningen. Ämnet med känd koncentration tillförs provlösningen tills dess att ekvivalenta mängder uppnåtts d.v.s. att alla molekyler/atomer/joner i provlösningen har bundit sig till ämnet i lösningen med känd koncentration. För att veta att ekvivalenta mängder uppnåtts nyttjas ett reagens, ett ämne som påvisar ett annat ämne genom färgskiftning, eller ett instrument. Utifrån mängden tillsatt ämne och dess koncentration samt den kända reaktionsformeln kan sedan koncentrationen av aktuella ämnen i provlösningen beräknas. Titrering används bl.a. som analysmetod för att fastställa vattnets hårdhet, koncentrationen av magnesium- och kalciumjoner. Vattnet utgör provlösningen och en EDTA-lösning med känd koncentration tillsätts för att kontrollera metalljonernas koncentration. För att fastställa när ekvivalenta mängder uppnåtts används ett reagens som först färgar vattnet rött p.g.a reaktion med metalljonerna. I takt med att EDTA-lösningen tillsätts kommer färgen övergå till blått. När lösningen är blå innebär detta att samtliga metalljoner bundit sig till EDTA-jonerna och att ekvivalenta mängder uppnåtts. Beräkningar görs därefter utifrån känd reaktionsformel, mängden vatten i provlösningen, tillsatt mängd EDTA-lösning och den använda EDTA-lösningens koncentration. I exemplet ovan vill man ta reda på koncentrationen av magnesium- och kalciumjoner i vatten och titrering är den bästa analysmetoden i detta fall eftersom den lämpar sig bäst för analys av koncentrationer i lösningar. |
|
|
Beskriv en kovalent bindning och ge/motivera ett exempel.
|
En kovalent bindning sker mellan två atomer med samma affinitet och samma elektronnegativitet.
Huvudsakligen betyder det att atomerna kommer att dela på ett elektronpar i samma utsträckning. Det ger elektronen ett större utrymme att röra sig i. Kovalenta bindningar är vanligast mellan två identiska atomer. Exempelvis i långa kolkedjor (exempelvis C-C eller C=C). Även mellan syrgas (O2) eller vätgas (H2). Oftast brukar man ta upp långa kolkedjor som exempel på kovalenta bindningar. |
|
|
Beskriv en jonbindning och ge/motivera ett exempel. Om du ska smälta något med jonbindningar, vad kan du förvänta dig.
|
Jonbindningar är helt enkelt en binding mellan en metall och en icke-metall. Det är den starkaste bindningen som kräver mest energi att bryta.
Vanligaste föreningen för natriumklorid eller koksalt. Eftersom att en jonbindning kräver en hög mängd energi för att smälta kommer man att behöva en extremt hög temperatur för att lyckas. |
|
|
Beskriv en metallbindning och ge/motivera ett exempel.
|
En metallbindning är helt enkelt en bindning mellan lika metallatomer. I och med att alla atomerna är av samma slag och därmed samma elektronnegativitet kommer elektronerna att ha ett stort frirum att röra sig. Denna egenskap utnyttjas för att leda ström.
Ett exempel är guld. Guld leder ström väldigt väl då den har många valenselektroner som rör sig längst ytan. Guld kan även hantera höga temperaturer. |
|
|
Vad är en vätebindning och ge ett exempel på vart aman kan finna vätebindningar?
|
Vätebindingar är en bindning som sker mellan två molekyler. Och bindningarna är specifik för mellan en väte och en negativt laddad atom, alla vätebindningar har gemensamt att det är minst ett väte inblandat.
Det är en typ av dipol-dipol bindning. Vatten är det vanligate exemplet. Bindningen sker mellan vätet hos en vattenmolekyl och syret hos en annan vattenmolekyl. Annars sitter DNA delvis ihop med hjälp av vätebindningar. |
|
|
Vad är en van der Waals-bindning?
|
Van der Waals-krafter är en samling av repulsiva och attraktiva krafter mellan molekyler. MAn säger också att krafterna är växelverkande, alltså att de kan växla mellan att vara repulsiva och attraherande.
Ett typiskt exempel är vatten, där det sker dipol-dipol interationer mellan väte- och syreatomer. |
|
|
Du har 0,05 mol HCl i en 1 dl lösning. Vad blir pH för lösningen?
|
n=c*V ==> c=n/V=0.05/1*10^⁻1=0,5 mol/dm3
[H+]=[HCl]=10^(pH) pH=-log([H+]) pH=0,3 |
|
|
Du har löst upp 0,20 mol NaOH i 0,70 liter vatten. Vad är pH i lösningen?
|
c=n/V=0,2/0,7=0,286
[OH-]=[NaOH]=10^(pOH) pOH=-log([OH-]) pOH=0,54 pH + pOH = 14 ==> pH=14-pOH=13,46 |
|
|
Du har en saltsyralösning med okänd koncentration. Hur ska du gå tillväga för att ta reda på pH hos syran?
Till hjälp har du en NaOH med koncentration på 0,5 mol/dm3. |
För att ta reda på koncentrationen hos syran kan man tillämpa titrering som metod.
Principen bakom titrering är at man ska kunna blanda en låg pH med en hög pH tills att man får en neutral pH. Med neutral pH menar man att koncetrationen vätejoner är lika stor som koncetrationen hydroxidjoner. [H+]=[OH-] (1) Vilket också innebär att man kan skriva detta samband. c(syra)*V(syra)=c(bas)*V(bas) för att ta fram koncentrationen hos syran c(syra)=c(bas)*V(bas)/V(syra) (2) För att kunna lösa uppgiften behöver vi hälla upp en bestämd volymsmängd av syran och genom att titrera kan vi bestämma hur stor volymsmängd bas som behövs för att neutralisera pH:t i syran. Endast då kan vi använda sambanden (1) och (2) och lösa uppgiften. |
|
|
Vad karaktärierar en alkohol?
|
En alokhol är en organisk molekyl (kolskelett) med en eller många -OH grupper.
Vad som ger alkohol dess egenskaper är att OH-gruppen är polär, vilket i sin tur poläriserar molekylen. Exempelvis att det kan bildas dipol-dipol bindningar molekyler emellan. Annars kan alkoholer också oxidera och avge en proton (som sitter på syret) eftersom att syret har en större elektronnegativitet än vätet. Syret kommer då oftast att få en dubbelbindning till det kolet den sitter på. (H-O--C-R --> O=C-R) oxiderar man en primär alkohol (en kolvätegrupp som sitter på kolet bundet till syret) får man aldehyder som kan oxideras vidare till karboxalsyror. (H-O--C-R --> O=C-R (aldehyd, slutar på -al)) Oxiderar man en sekundär får man ketoner. Beroende på hur många OH-grupper som sitter på molekylen kommer namnet att ha olika ändelser. En tvåvärdig alkohol (två stycken OH) kommer att ha ett namn som slutar på -diol. En trevärdig kommer att sluta på -triol. |

