![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
16 Cards in this Set
- Front
- Back
|
Definición de reacción química |
Proceso de transformación de la materia |
|
|
Sustancias en una reacción química |
Iniciales o Reactivos: antes de ser transformados Productos: después de ser transformados |
|
|
La forma general de escribir una reaccion quimica |
Reactivos → Productos |
|
|
simbologia de las reacciones quimicas |
(s): sustancia en estado solido (l:) sustancia líquida (g): sustancia gaseosa (ac): sustancia en disolución ↑: desprendimiento de un gas ↓: precipitacion de un solido ▲: Calorías añadidas al sistema |
|
|
¿A qué se le llama fórmula química? |
la representación simbólica de una reacción química |
|
|
¿A qué se le llama estequiometría? |
Estudio de las relaciones que existen entre las cantidades de reactivos y productos involucrados en una reaccion quimica |
|
|
¿Cuáles son los coeficientes estequiométricos? |
El numero de particulas quimicas que intervienen en la reaccion quimica (el subíndice) |
|
|
Tipos de reacciones quimicas |
Por el comportamiento energetico: Endotérmica: cuando es necesario aplicar calor Exotérmica: cuando se libera calor Complejidad de la reacción: Síntesis: (A+B → AB) Descomposición: (AB + energía → A + B) Desplazamiento simple: (A + BC → AC+B) Doble desplazamiento: (AB + CD → AD + CB) Clasificación analítica: óxido-reducción: una sustancia pierde electrones (óxida) y otra los gana (reduce) Combustión: un combustible reacciona con un comburente (generalmente óxigeno) produciendo calor o luz Neutralización: ácido-base Precipitación: formación de un sólido |
|
|
Leyes Ponderales |
1.- Conservación de la materia: la masa de los reactivos debe ser la misma de los productos 2.-Proporciones fijas o constantes: Muestras diferentes de un mismo compuesto siempre contienen los elementos constituyentes en las mismas proporciones en masa. Cuando dos o más sustancias reaccionan para formar nuevas sustancias, lo hacen siempre en una proporción fija y definida por la ecuación que representa la reacción. |
|
|
fórmula de masa |
Suma aritmética de masas atómicas de los átomos presenta en la fórmula del compuesto. |
|
|
mol |
Unidad de cantidad de sustancia que contiene tantas unidades elementales como átomos hay en 12 gramos del isótopo de carbono 12(^12C) |
|
|
Número de Avogadro (N) |
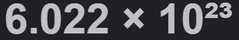
|
|
|
masa molar |
Expresa la masa de un mol de dicha sustancia expresada en gramos Se expresa en gr/mol |
|
|
Formulas para obtener la masa molar |
g = (n) (m) norte = gramo / metro g=masa en gramos n=mol m=masa molar |
|
|
mol a mol |
Paso 1. Identificar las sustancias de partida y la que se buscan. Paso 2. Balancear la formulacion quimica. Paso 3. Establecer la relación molar entre las dos sustancias involucradas en el problema. Paso 4. Se multiplica el dato conocido por el factor molar |
|
|
masa a masa |
Paso 1. identificar y anotar el dato conocido y el buscado. Paso 2. Convertir los gramos de la sustancia de partida a moles utilizando análisis con el uso del o los factores de cinversión necesarios. Paso 3. Convertir los moles encontrados a moles de la sustancia problema multiplicando los mismos por el factor molar obtenido de la química química. Paso 4. Convertir los moles encontrados a gramos. |

