![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
58 Cards in this Set
- Front
- Back
- 3rd side (hint)
|
GMP의 정의 ☆☆☆ |
품질이 보증된 우수의약품을 제조하기 위하여 제조소의 구조, 설비를 비롯하여 원자재 구입 》입고 》제조 》포장 》출하에 이르기까지 생산공정 전반에 걸쳐 지켜야 할 요건을 규정하고 문서화 하는 것 |
|
|
|
GMP의 역사 |
(○) 1906년 미국 최초의 Food and Drug Act 제정 (○) 1937년 Sulfanilamide 시럽제의 용제 사건 (×) 1952년 Kefauver-Harris Amendments (○) 1952년 Durham-Humphery Amendment (○) 1950 말~1960 초 Thalidomide 사건 (○) 1962년 Kefauver-Harris의 FD&C법 개정안 통과 (○) 1963년 FDA cGMP 제정 (○) 1969년 WHO-GMP 제정 (○) 1975년 국제거래에서 ‘GMP 증명제도’ 실시 권고 (○) 1977년 KGMP 제정 |
|
|
|
cGMP |
current GMP |
|
|
|
PIC/S |
• GMP 국제기구 • PIC/S = PIC + PICS • Pharmaceutical Inspection Cooperation Scheme(의약품실사협력기구) |
|
|
|
KGMP의 적용범위 |
(×) 방사성 완제의약품 (×) 한약분말 또는 엑스 (○) 생약(한약)제제 포함 (○) 원료의약품도 적용 (○) 생물학적제제 (○) 유전자재조합 의약품 (○) 세포배양 의약품 (○) 유전자치료제 (○) 세포치료제 (○) 생물의약품 |
|
|
|
GMP 기준서 ☆☆ |
(×) 제조지시서 (○) 제조관리기준서 (○) 제조위생관리관리기준서 (○) 제품표준서 (○) 품질관리기준서 |
|
|
|
KGMP의 주요 내용 ☆ |
(×) 합리적인 생산수율의 증대 (○) 인위적인 과오(혼동, 실수)의 최소화 (○) 의약품의 오염(교차, 미생물, 이물) 방지 (○) 고도의 품질보증체계의 확립 (○) 의약품 품질변화의 방지
|
|
|
|
GMP의 구조, 설비 |
(×) 작업원에게 작업에 관한 교육, 훈련 (○) 작업실은 작업에 지장이 없는 크기로 할 것 (○) 의약품의 제조에 필요한 시설을 설치 (○) 작업의 종류에 따라 분리, 구획, 구분 |
|
|
|
제조기록서 |
(×) 원료약품의 분량의 실사용량이 기준량과 다른 경우 그 사유만을 기록한다 (○) 원료약품의 분량의 실사용량이 기준량과 다른 경우 그 사유와 산출근거를 기록한다 (○) 제조단위마다 제조기록서를 작성하되 제조지시서와 통합하여 작성할 수 있다 (○) 공정별 수율관리기준을 벗어난 경우에 그 사유를 작성한다 (○) 주요 공정에는 작업원과 확인자의 서명, 작업 연월일 시간을 기록한다 (○) 제품명, 제조번호, 제조단위가 기록된다 |
|
|
|
CMC 조정위원회 의제 ☆ |
(×) 생산 계획의 변경 (○) 관련 GMP 문제 및 조치 사항 (○) 신제품/신공정 적격성평가 및 밸리데이션 (○) 공장내 또는 공장간 기술이전 (○) 새로 도입되는 제품/공정의 PAI 문제 (○) 현재 승인되어 있는 제품/공정의 변경관리, 스케일-업, 승인 후 변경 (SUPAC) |
|
|
|
CMC 조정위원회에 참여하는 분야 ☆ |
(×) 판촉분야 (○) 처방개발 (○) 공정개발 (○) 제조 (포장작업 포함) (○) 엔지니어링 (자동화 및 컴퓨터시스템 포함) (○) 품질보증 (○) 분석법개발 또는 품질관리 (○) 원료의약품 작업 (○) IT 작업 |
|
|
|
비무균 제품 밸리데이션 우선 순위 ☆☆☆ |
1) 저용량/고효력 정제 및 캡슐, 경피흡수제제 (patch) 2) 안정성에 문제가 있는 의약품 3) 기타 정제와 캡슐 4) 경구액제, 국소치료제, 진단보조제
|
|
|
|
CMC 조정위원회 |
Chemistry, Manufacturing and Control |
|
|
|
시험법 밸리데이션 파라미터
|
특이성, 정확성, 정밀성, 검출한계, 범위, 완건성 등
|
|
|
|
품질관리기준서 사항 |
(×) 공정검사의 방법 (○) 시험지시서 (○) 검체의 채취자, 채취량, 채취방법, 채취 주의사항 (○) 시험시설 및 시험기구의 점검 (○) 주성분 및 완제품 등 보관용 검체의 관리 |
|
|
|
무균 제품 밸리데이션 우선 순위 ☆☆☆
|
1) 대용량 주사제 (large volume parenteral: LVPs)
2) 소용량 주사제 (small volume parenteral: LVPs) 3) 안과용 제제, 기타 무균제제 및 의료기기 |
|
|
|
회고적 밸리데이션의 선정 ☆☆
|
(○) 최근에 생산된 20여 배치에서 제조방법, 관리기준이 유지되는 경우
(×) 하나 또는 그 이상의 주성분이나 주요 첨가제가 관련된 처방변경 (×) 기존에 사용된 것과 다른 신규 장비의 도입 (×) 제품의 품질 특성에 영향을 미칠 수 있는 제조방법의 변경 (×) 제조시설의 변경 (×) 실생산 규모로 제조한 5~10 개의 제조단위 (×) 실생산 규모이지만 판매하지 않은 제조단위 |
|
|
|
회고적 밸리데이션 고려사항☆☆
|
(○) 기존 제품에 대해 수행한다
(○) 공정이 안정하다고 판단되면 판매를 위해 제조 했던 batch의 과거 생산 기록들 (공정변수 및 시험결과)을 통계 처리한다 (○) 원하는 제품의 규격을 유지하기 위한 공정변수들의 관리범위 및 상태를 보고한다 (○) QC 결과 부적합 배치 혹은 재가공 배치는 회고적 밸리데이션 배치로 부적합하다 (○) 약물 부작용 보고 프로그램을 통한 불만 사항도 검토한다 (○) 수율을 작업의 효율성을 반영하지만 공정수행의 특정한 정보를 반영하지 않는다 (×) 과거의 안정성 데이터는 근거로 할 필요가 없다 (×) 주성분, 첨가제와 같은 원료는 제품 품질에 대한 편차의 원인이 될 수 없다 |
|
|
|
동시적 밸리데이션 ☆ |
• 현재 생산 중인 batch의 공정변수 모니터링 값과 이 때 완제품 등의 시험 결과 data를 이용한 밸리데이션 |
|
|
|
예측적 밸리데이션 ☆☆ |
(○) 제품 출시 전 밸리데이션 실시계획서를 수립하고 수행하여 밸리데이션에 필요한 데이터를 얻는다 (○) 신제품 및 그 제조공정을 처음 도입할 때 수행한다 (○) 실사 결과가 3개 제조단위 모두 기준에 적합해야 한다 (×) 실생산 규모이지만 판매를 목적으로 하지 않는다 (×) 3개 제조단위는 인접한 제조단위로 연속적일 필요는 없다 (×) 의약품을 제조, 판매하면서 실시할 수 있다 |
|
|
|
제조지시서 사항 |
(×) 안정성 시험 (○) 제품표준서의 번호 (○) 제품명, 제형, 성상 (○) 상세한 제조방법 및 작업 중 주의사항 (○) 공정별 수율관리 기준 |
|
|
|
공정 밸리데이션 ☆ |
(×) 시험법 밸리데이션 (analytical method validation) (○) 예측적 밸리데이션 (prospective validation) (○) 동시적 밸리데이션 (concurrent validation) (○) 회고적 밸리데이션 (retrospective validation) (○) 재밸리데이션(revalidation) |
|
|
|
공정 밸리데이션의 내용 ☆ |
(×) 중요한 제조공정에 대해서는 회고적 밸리데이션을 우선적으로 실시한다 (○) 중요한 제조공정에 대해서는 예측적 밸리데이션을 우선적으로 실시한다 (○) 의약품 제조공정은 미리 설정된 기준 및 품질 특성에 맞는 제품을 일관되게 제조한다는 것을 검증하고 문서화하여야 한다 (○) 중요한 제조공정에 대해서 부득이한 경우에는 동시적 밸리데이션으로 갈음할 수 있다 (○) 무균제제 무균공정의 경우에는 공정별로 실시한다 (○) 무균제제 이외에는 품목별로 공정 밸리데이션을 실시한다 |
|
|
|
의약품 제조 및 품질관리 기준 법령 |
의약품등 안전에 관한 규칙 |
|
|
|
재밸리데이션의 대상 ☆ |
(×) 제조관리자의 변경 (○) 원자재의 변경 (○) 제조방법의 변경 (○) 제조공정의 변경 (○) 구조설비의 변경 |
|
|
|
IP
|
설치 적격성평가 (Installation Qualification)
|
기계, 설비 또는 시스템이 설정된 기준에 맞게 설치되었는지를 현장에서 검증하고 문서화하는 것
|
|
|
PQ
|
성능 적격성평가 (Performance Qualification)
|
기계, 설비 또는 시스템이 설정된 품질기준에 맞게 제품을 제조할 수 있는지를 검증하고 문서화 하는 것
|
|
|
DQ
|
설계 적격성평가 (Design Qualification)
|
기계, 설비 또는 시스템의 설계가 의도한 목적에 적합한지를 검증하고 문서화 하는 것
|
|
|
OP
|
운전 적격성평가 (Operational Qualification)
|
기계, 설비 또는 시스템이 예측된 운전범위 내 에서 의도한 대로 가동하는지를 검증하고 문서화 하는 것
|
|
|
공정 밸리데이션 순서 ☆
|
1) 실시대상 선정 및 목적 설정
2) 목표로 하는 품질 기준 확인 3) 공정의 특성 확인 및 가동 조건 결정 4) 실시계획서 작성 5) 제조 및 시험 시설 교정, 적격성 평가 6) 밸리데이션 실시 7) 실시 결과 수집, 정리, 분석 8) 결과 종합 평가 및 문서화 |
|
|
|
동시적 밸리데이션의 대상 ☆
|
(×) 이미 밸리데이션이 완료된 공정에 대하여 공정이 계속적으로 유효한지에 대해 정기적으로 실시할 경우
(○) 적용 대상이 드물고 대체 의약품이 없어 긴급한 도입이 요구되는 경우 (○) 희귀 질환 치료용 의약품을 제조하는 경우 (○) 연간 생산하는 제조단위가 1개 이하인 경우 |
|
|
|
밸리데이션 계획서 사항
|
(×) 원료약품 및 원료약품의 분량, 기계, 설비, 공정흐름도, 상세한 공정, 주요 공정의 변수 등
(○) 밸리데이션 방침 (○) 밸리데이션 조직 (○) 밸리데이션 대상 및 그에 대한 설명 |
|
|
|
공정 밸리데이션 중에 작성 문서
|
(×) 제품표준서
(○) 공정흐름도 (○) 제조기록서 (○) 안정성평가 |
|
|
|
제품표준서 (Master Product Document)
|
(×) 위생관리
(○) 기준규격 (○) 시험방법 (○) 제조지침 (○) 공정흐름도 |
|
|
|
실제조단위로의 생산규모 증대를 위해서 실시하는 연구
|
(×) 시험 방법의 설정
(○) 공정 매개 변수의 영향 (○) 공정 특성의 분석 (○) 공정 특성의 검증 (○) 실제조단위에서 시험 뱃치 생산 |
|
|
|
증기 멸균법의 생물학적 지표 세균
|
Bacillus stearothermophilus
|
|
|
|
D 값 (Decimal reduction time) ☆☆☆
|
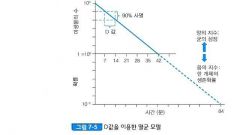
미생물 수가 90% 감소하는 데 소요되는 시간
(미생물 수가 1/10 되는 데 필요한 시간) |
|
|
|
Z 값 ☆☆☆
|
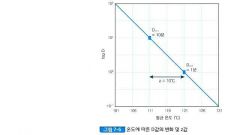
D 값이 1 log 감소하는 데 필요한 온도
(시간이 1/10 되는 데 필요한 온도) |
|
|
|
Z값 비교
|
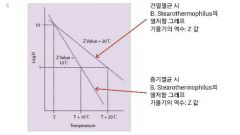
• 위에서 건열멸균법의 Z 값 = 20°C
증기멸균법의 Z 값 = 10°C • 증기멸균법에서 열저항력이 약해서 미생물이 잘 사멸된다 |
|
|
|
F 값 (equivalent sterilization time)
|

F 값은 기준온도에서의 유효 노출시간
(온도 T에서 기준온도 To와 동등한 효과를 얻기 위해 필요한 시간) |
|
|
|
Fo 값 (equivalent sterilization time at 121.1°C) ☆☆☆
|

Z 값이 10°C 이고, 기준온도 To가 121°C 일 때의 F 값
(121°C와 동등한 효과를 얻기 위해 필요한 시간) |
|
|
|
B 값
|

생존한 미생물 수
|
|
|
|
overkill 법 ☆☆☆
|
생물학적 지표가 12 log 감소가 일어 날수 있도록 충분한 열을 받는 다는 것
|
|
|
|
D 값에 영향을 주는 인자
|
(○) 미생물 종류
(○) 제품 구성 성분 (○) 제품 용기의 특성 |
|
|
|
SLR
|

spore log reduction
|
|
|
|
건열 멸균주기의 생물학적 공정 밸리데이션
|
(1) 건열에 가장 널리 사용되는 생물학적 지표 : B. subtilis
(2) 170℃에서 가장 강한 미생물 포자의 D 값은 6~10 min 임 (3) 허용할 수 있는 미생물의 건열 저항에 대한 Z 값은 20℃ 임 (4) 발열성 물질의 건열 저항을 사용할 수 있도록 제안된 Z 값은 54℃ 임 |
|
|
|
열 침투 시험
|
(○) 반복 시험해서 얻어진 F0 값이 통계적으로 일관성이 있는 지와 원하는 F0 값 이상인지 증명함
(○) 열 침투 시험 결과는 적재된 상태에서 가장 차가운 지점을 예측하는 데 도움이 되어야 함 (○) 콜드스팟은 반복시험 중 변하면 안 됨 (○) 일반적으로 용기 내부의 콜드스팟은 용기의 하단과 측벽하단의 연접부위이다 (○) 용기내부와 함께 내부 벽면 또한 멸균되어야 하기 때문에 용기의 안쪽 표면에 열전대가 닿아 있어야 함 (○) 모든 적재와 용량별 3~5회의 반복 실행 시 10~20개의 열전대를 분산시켜 수행해야 함 |
|
|
|
열 분포 시험
|
목적은 가장 가열하기 힘든 지역을 결정하기 위함임
|
|
|
|
습식 열멸균 공정관 관련이 있는 시간 3가지
|
- 최소 F 값
- 설계 F 값 - 멸균공정시간 |
|
|
|
중요 공정 단계
|
제조과정 중 관리되지 않으면 최종 제품의 품질에 영향을 줄 수 있는 작업
|
|
|
|
x-bar 관리도
|
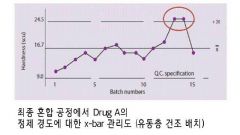
|
|
|
|
고형제제의 공정 중 시험항목
|
(×) 용출
(○) 수분함량 (○) 혼합균일성 (○) 붕해 |
|
|
|
마손도
|
chipping, 균열, 가루날림을 방지하기 위한 특성
|
|
|
|
균일한 혼합물 형성에 관여하는 특성
|
(×) 흡습성
(○) 겉보기 밀도 (○) 입자 모양 (○) 표면적 |
|
|
|
정제를 코팅하는 이유
|
(×) 수분 방출
(○) 안정성 (○) 맛 은폐 (○) 취급 안전성 |
|
|
|
습식과립법 파라미터
|
(×) 입/출구 온도
(○) 결합제 첨가 (○) 결합제 농도 (○) 과립화 종말점 |
|
|
|
Particle size의 주요 공정 변수
|
(×) polymorphism
(○) flow (○) blend uniformity (○) binder uptake (○) compressibility (○) lubricant efficiency |
|
|
|
과립 건조 불량 현상
|
(×) capping
(○) 정제의 picking (○) 펀치로의 sticking (○) 가수분해로 인한 안정성 저해 |
|

