![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
14 Cards in this Set
- Front
- Back
|
Enthalpie |
Mesure de l'énergie du système qui peut être dégager sous forme de la chaleur. |
|
|
Loi de la conservation de l'énergie |
La perte d'énergie du système chimique est égale au gain de l'énergie du milieu. Énergie ne peut pas être produit ni perdu. |
|
|
Exothermique |
Énergie du système diminue. De la chaleur est dégagé. L'enthalpie molaire est négatif. |
|
|
Endothermique |
Énergie du système augmente. De la chaleur est absorbé. L'enthalpie molaire est positif. |
|
|
Diagramme d'énergie potentiel: exothermique |
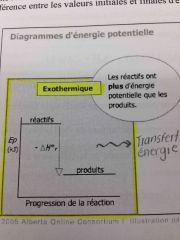
Back (Definition) |
|
|
Diagramme d'énergie potentielle: endothermique |
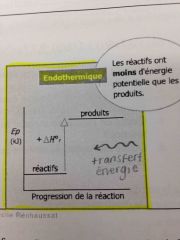
Back (Definition) |
|
|
La loi de Hess |
La chaleur émise ou absorbé lors d'un processus chimique est la même, qu'elle se produise en une ou plusieurs étapes.
Permet de déterminer la variation de l'enthalpie. |
|
|
Enthalpie molaire standard de formation. |
H=enthalpie des produits-enthalpie des réactifs |
|
|
Calorimétrie |
nH=mct |
|
|
Énergie d'activation |
Énergie minimale requise pour obtenir une réaction. |
|
|
Collision efficace |
Collision avec un orientation appropriée des particules (réactifs). Ainsi que un énergie de collision suffisant est nécessaire. |
|
|
Collision inefficace |
Les molécules entrent en collision mais n'ont pas une bonne orientation. Alors aucun nouvelle substance ne se produit. |
|
|
Énergie de liaison |
Énergie requise pour rompre une liaison chimique. Énergie libéré à la formation d'une liaison. |
|
|
Catalyseurs |
Accélère la vitesse d'une réaction chimique. Sans y être consommée. Moins d'énergie d'activation est requise. La complexe activer et l'enthalpie ne change pas. |

